
පිටු අන්තර්ගතයේ දර්ශකය
En හරි සංචිත ප්රතිසංස්කරණය ඇතුලේ තටාක ජල නඩත්තු මාර්ගෝපදේශය පහත ලිපියට ඔබව හඳුන්වා දීමට අපට අවශ්යයි: තටාකයේ ජලයේ ක්ෂාරීය බව මනින්නේ කෙසේද?
තටාක ක්ෂාරීය එය කුමක්ද

ක්ෂාරීය තටාකය: තටාක ජලය විෂබීජහරණය කිරීමේ මූලික පරාමිතිය
මුලින්ම එය ඉස්මතු කරන්න අපි නඩත්තු කරන විට පාලනය කළ යුතු මූලික පරාමිතීන්ගෙන් එකක් වන්නේ තටාකයේ pH අගය සමඟ ක්ෂාරීයත්වයයි.
තටාකයේ ජලයෙහි රසායන විද්යාව පිළිබඳ නිවැරදි ප්රතිකාරයක් සිදු කරන්නේ කෙසේද?
ක්ෂාරීය බව යනු ජලයේ ස්වාරක්ෂක ගුණ මනින මිනුමක් වේ.
එය ලීටරයකට (mg/L) කැල්සියම් කාබනේට් මිලිග්රෑම් වලින් මනිනු ලබන අතර සාමාන්යයෙන් 80-120 mg/L පරාසයක පවතී.
අම්ල උදාසීන කළ හැකි හයිඩ්රජන් අයන සඳහා සංචිතයක් ලෙස ක්රියා කරන නිසාත් pH අගය අඩු වීමටත් ඉඩ ඇති නිසා ක්ෂාරීයතාව pH අගයට නිශ්චිත බලපෑමක් ඇති කරයි.
එබැවින්, 80-120 mg/L ක්ෂාරීය අගයක් ජල රසායනය වෙනස් වුවද pH අගය තරමක් ස්ථායී බව සහතික කරයි.
මීට අමතරව, ලෝහවල විඛාදනයට ක්ෂාරීයත්වය කාර්යභාරයක් ඉටු කරයි, ලෝහ මතුපිට හානිවලින් ආරක්ෂා කරන තෙතමනය බාධකයක් ලෙස ක්රියා කරයි.
එබැවින් නේවාසික සහ වාණිජ ජලය භාවිතා කරන්නන්ට ප්රමාණවත් ක්ෂාරීය අගයක් වැදගත් වේ.
තටාක ක්ෂාරීයත්වය යනු කුමක්ද?
ආරම්භ කිරීමට, එය පැහැදිලි කරන්න ක්ෂාරීය බව තමයි අම්ල උදාසීන කිරීමට ජලයට ඇති හැකියාව, ජලයේ දිය වී ඇති සියලුම ක්ෂාරීය ද්රව්ය (කාබනේට්, බයිකාබනේට් සහ හයිඩ්රොක්සයිඩ්) මැනීම, නමුත් බෝරේට්, සිලිකේට්, නයිට්රේට් සහ පොස්පේට් ද තිබිය හැක.
ක්ෂාර ලෙස ක්රියා කරයි pH වෙනස්වීම් වල බලපෑම නියාමනය කිරීම.
එබැවින්, ඔබ සුදුසු අගයන් සමඟ මුලසුන නොගන්නේ නම්, හොඳින් විෂබීජහරණය කළ හා විනිවිද පෙනෙන ජලය ඔබේ තටාකයේ තබා ගැනීමට ඔබට නොහැකි වනු ඇත.
නිර්දේශිත තටාක ක්ෂාරීය මට්ටම
තටාක ක්ෂාරීයත්වය නිර්දේශිත 125-150 ppm අතර වේ.
මතක් කිරීම: සමහර අවස්ථාවලදී, ජලයෙහි නිවැරදි pH අගය තිබිය හැක, නමුත් ඒ වෙනුවට ක්ෂාරීයතාව අඩු හෝ වැඩි විය හැක.
තටාකයේ ජලයේ pH අගය සහ භාෂ්මිකතාවය සම්බන්ධ වන ආකාරය

තටාකයේ pH අගය කුමක්ද?
pH හි ස්වභාවික වැඩිවීම: කාබන් ඩයොක්සයිඩ් නැතිවීම
ද්රාවණයක pH අගය හයිඩ්රජන් අයනවල සාමාන්ය සාන්ද්රණයේ අගයේ සෘණ ලඝුගණකය ලෙස අර්ථ දැක්වේ.
- H අයන H2O සහ H2CO3 බවට විඝටනය විය හැකි බැවින්, pH අගය ආකාර දෙකකින් වෙනස් කළ හැක: H2O එකතු කිරීම හෝ ඉවත් කිරීම හෝ H2CO3 එකතු කිරීම හෝ ඉවත් කිරීම. වාෂ්පීකරණය හරහා තටාකයකින් කාබන් ඩයොක්සයිඩ් නැති වූ විට, pH අගය වැඩි වේ.
- මෙයට හේතුව H2CO3 H2O ට වඩා බෙහෙවින් වැඩි ආම්ලිකතාවයක් ඇති බැවිනි; අම්ල සමානාත්මතාවය අනුව, 2 හි H3O හි Kw හා සසඳන විට H3400CO2 හි Kw 25 වේ.
- හෙන්රිගේ නියමයට අනුව, CO2 සඳහා K a 3,18 වේ. pH අගය වැඩි වන විට, H අයන සාන්ද්රණය වැඩි වන අතර, අතිරික්ත ප්රෝටෝන අවසානයේ H2O සහ H2CO3 බවට "අයනීකරණය" වේ.
එබැවින්, අම්ල තටාකයකදී, pH අගය වෙනස් වීමේ වේගය අවසානයේ සීමා වන්නේ H2CO3 සහ H2O අතර ප්රතික්රියා අනුපාතය මගිනි.
- ; මෙම වේගය උෂ්ණත්වය මත මෙන්ම කැල්සියම් සල්ෆේට් හෝ බයිකාබනේට් වැනි නිෂේධකවල පැවැත්ම මත රඳා පවතී.
- එබැවින්, ස්ථාවර ඉලක්ක අගයන් සහිත සාම්ප්රදායික pH පාලන ක්රම භාවිතා කරනවාට වඩා, ඉතිරි සංචිත රසායන විද්යාව සමඟ එක්ව pH අගය පාලනය කිරීම වැදගත් වේ.

කාබන් ඩයොක්සයිඩ් (CO2) වායුව ඇති විට ජලයෙන් ඉවත් කරන ආකාරය මෙම රූප සටහනෙන් දැක්වේ.
- ජලය වාතනය කළ විට ජලයේ දිය වී ඇති කාබන්ඩයොක්සයිඩ් ස්වභාවිකව ජලයේ දිය වීමට පටන් ගනී.
- අතිරික්ත කාබන්ඩයොක්සයිඩ් තටාකයේ මුදුනට නැඟී ඇති අතර, එය ග්රහණය කර වායුගෝලයට මුදා හැරිය හැක.
තටාකය සිසිල් වන තරමට CO2 ස්වභාවිකව ජලයෙන් පිටතට පැමිණේ.
- බොහෝ වාෂ්පීකරණයක් සහිත උණුසුම්, අව්ව සහිත දේශගුණයක් තුළ, කාබන් ඩයොක්සයිඩ් මට්ටම අපේක්ෂිත පරාසය තුළ තබා ගැනීම සඳහා දිනකට කිහිප වතාවක් ජලය වාතනය කිරීම පවා අවශ්ය විය හැකිය.
CO සමතුලිතතා ක්රියාවලියේ රූප සටහන2,

CO2 ස්වභාවිකවම ජලයේ මතුපිට සහ අවට වාතය අතර සමතුලිතතාවය සෙවීමට නැඹුරු වේ.
එබැවින්, CO2 තටාකයට ඉහළින් ඇති වාතය සමඟ සාපේක්ෂ සමතුලිතතාවයේ පවතින තෙක් නිදහස් වේ. මෙම සංසිද්ධිය හෙන්රිගේ නියමය ලෙස හැඳින්වේ.
CO2 ස්වභාවිකවම ජලයේ මතුපිට සහ අවට වාතය අතර සමතුලිතතාවය සෙවීමට නැඹුරු වේ.
එබැවින්, CO2 තටාකයට ඉහළින් ඇති වාතය සමඟ සාපේක්ෂ සමතුලිතතාවයේ පවතින තෙක් නිදහස් වේ. මෙම සංසිද්ධිය හෙන්රිගේ නියමය ලෙස හැඳින්වේ.
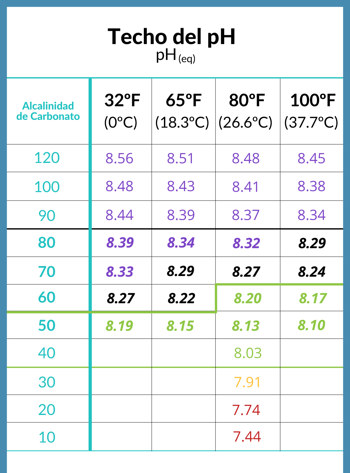
තටාකයේ ජලය සහ ක්ෂාරීය pH මට්ටමේ සිවිලිම අතර සම්බන්ධය
ඉහළ pH තටාක ජලය සහ ක්ෂාරීයත්වය සමඟ සහසම්බන්ධය
- ජලජ පද්ධතිවල pH අගය ජල රසායන විද්යාවට විශාල බලපෑමක් ඇති කරයි.
- pH අගය විවිධ අයනවල සාන්ද්රණය පාලනය කරන අතර pH හි වෙනස්වීම් පවතින විශේෂ වර්ග සහ සංඛ්යාවට බලපෑම් කළ හැක.
- උදාහරණයක් ලෙස, pH අගය 7 පරිසර පද්ධතියේ ක්රියාකාරිත්වය පවත්වා ගැනීම සඳහා ඉතා සුදුසු වේ, නමුත් pH අගය 8 සමහර ජීවීන් සඳහා ඉතා අඩු සහ අනෙකුත් විශේෂ සඳහා ඉතා ඉහළ විය හැක.
ජලයේ ඇති CO2 ජල මතුපිටට ඉහළින් ඇති වාතය සමඟ සමතුලිතතාවයට ළඟා වූ විට, pH අගය එහි සිවිලිමට ළඟා වී ඇති බව කියනු ලබන අතර, එම සිවිලිම ජලයේ ඇති කාබනේට් ක්ෂාරීය මට්ටම අනුව තීරණය වේ.
- pH සිවිලිම, හෝ සමස්තයක් ලෙස ජලය සඳහා වඩාත් සුදුසු pH අගය තීරණය කරනු ලබන්නේ ජලයේ කාබනේට් ක්ෂාරීයත්වය මගිනි.
- විවිධ තත්වයන් යටතේ ඇති විවිධ සිවිලිම් රසායනඥ රිචඩ් ෆෝක් විසින් සපයන ලද පහත වගුවේ දැකිය හැකිය.
තටාකයේ ක්ෂාරීයත්වය සහ ජලයේ pH අගය වෙනස් වන්නේ කෙසේද?
තටාක ක්ෂාරීයත්වය සහ ජල pH මට්ටම අතර වෙනස
pH අගය සහ ක්ෂාරීය බව අතර වෙනස කුමක්දැයි ඔබ කවදා හෝ කල්පනා කර තිබේද?
ක්ෂාරීය මට්ටම ඉහළ යැයි සලකන විට
එක් අතකින්, කැල්සියම් කාබනේට් සාන්ද්රණය විට 175 ppm ට වැඩි, අපි අධික ක්ෂාරීය බව ගැන කතා කරමු.
අධික ක්ෂාරීයත්වය බලපායි
මීළඟට අපි සඳහන් කරන්නේ ක්ෂාරීය බව වැඩි වූ විට ඇතිවන බලපෑම් කිහිපයක්.
- pH හි සැලකිය යුතු වැඩි වීමක්.
- විනිවිද නොපෙනෙන, පෙනෙන විදිහට වළාකුළු පිරි ජලය.
- ඇස්, කන්, නාසය සහ උගුරේ කෝපයක්.
- බිත්ති සහ උපාංග මත පරිමාණය සෑදීම.
- තටාක ද්රව්ය ඇඳීම වේගවත් කිරීම.
- තටාකයේ විෂබීජ නාශක වල කාර්යක්ෂමතාව නැතිවීම.
අධික ක්ෂාරීයත්වය ඇතිවන්නේ කුමක් නිසාද?
ක්ෂාරීය බව වැඩිවීම විවිධ සාධක නිසා විය හැක. ඔවුන් ඔවුන්ගෙන් කැපී පෙනේ:
- සූර්යයාගේ සහ සුළඟේ ක්රියාකාරිත්වය හේතුවෙන් ජල පරිමාවේ වෙනස්වීම් හේතුවෙන් ජලය වාෂ්ප වීම ක්ෂාරීය බව වැඩි වීමට හේතු වේ.
- සන් ක්රීම්, දහදිය සහ අපද්රව්යවල බලපෑම හේතුවෙන් තටාකය භාවිතය හරහා ක්ෂාරීය බව වැඩි වේ.
- සමහර විට අපි ජලය පුරවන විට, එය කාබනේට් පාෂාණ සමඟ සම්බන්ධ වී ඇත්නම් එය ඉහළ ක්ෂාරීය තටාකයක් තිබිය හැක.
- රසායනික ද්රව්ය අනිසි ලෙස භාවිතා කිරීම.
- තටාක පෙරහන පද්ධතියේ අක්රමිකතා.
තටාකයේ ක්ෂාරීය බව අඩු කරන්නේ කෙසේද?
තටාකයේ ක්ෂාරීය බව අඩු කරන්නේ කෙසේද?
- පළමුව, අපි තටාක පොම්පය නිවා දමා පැයක් පමණ රැඳී සිටිය යුතුය.
- ඊළඟට, අවශ්ය pH අගය අඩු කරන්නා (පහසුව අනුව) එකතු කිරීම සහ එය බයිකාබනීකෘත කාබන් ඩයොක්සයිඩ් බවට පරිවර්තනය කිරීම සඳහා එය බෙදා හැරීම අවශ්ය වේ. සටහන: තටාකයේ ක්ෂාරීයතාවයේ 10 ppm අඩු කිරීම සඳහා, තටාක ජලයේ එක් එක් ඝන මීටර් සඳහා මිලි ලීටර් 30 ක් පමණ බෙදා හැරීම අවශ්ය වේ (ද්රව හෝ ඝන ආකෘතියෙන්).
- ඉන්පසුව, පැයකට පසු, අපි පොම්පය නැවත සක්රිය කරමු.
- පැය 24 කට පමණ පසු, අපි නැවතත් ක්ෂාරීය මට්ටම් මැන බලමු.
- අනෙක් අතට, දින 2 ක් හෝ 3 ක් තුළ තටාකයේ ජල ක්ෂාරීය මට්ටම පහත වැටී නොමැති බව අපි නිරීක්ෂණය කළහොත්, අපි නැවතත් ක්රියාවලිය නැවත කරන්නෙමු (සමහර විට එය මිල අධික ක්රියාවලියක් විය හැකිය).
- මීට අමතරව, සෑම විටම අපි pH මට්ටම් සමාලෝචනය කළ යුතුය, මන්ද මේවා පහත වැටිය හැක.
[amazon box= «B00PQLLPD4» button_text=»මිලදී ගන්න» ]
ක්ෂාරීය මට්ටම අඩු යැයි සලකන විට
මෙම අවස්ථාවේ දී, කැල්සියම් කාබනේට් සාන්ද්රණය විට 125 ppm ට වඩා අඩු, අපි අඩු ක්ෂාරීයතාවයක් ගැන කතා කරමු.
අඩු ක්ෂාරීය ප්රතිවිපාක
ජලයේ ක්ෂාරීයතාවය පහත වැටීමෙන් ඇතිවන බලපෑම් අතර අපට සොයාගත හැකිය:
- සාමාන්යයෙන් අපේ සංචිතයේ pH අගය අඩුයි. ඊට අමතරව, එය පාලනය කිරීමට සහ ස්ථාවර කිරීමට අපහසු වනු ඇත.
- මෙම තත්ත්වයන් නිසා, එම කාර්යක්ෂමතාවය නොමැති නිසා අපි විෂබීජ නාශක ගොඩක් පරිභෝජනය කරන්නෙමු.
- පෙරීමේ පද්ධති අධික ලෙස වෙහෙසීම.
- අපේ තටාකයේ ජලය කොළ පාටින් පෙනෙනු ඇත.
- එය තටාකයේ ලෝහ කොටස් සහ උපාංග මත විඛාදනයට හා පැල්ලම් වලට තුඩු දෙයි.
- එසේම, එය ඇස්, නාසය, උගුර සහ සමේ කෝපයක් ඇති කරයි.
- අවසාන වශයෙන්, ඔබ අඩු pH අගය සමඟ අඩු ක්ෂාරීයතාවයක් ඇති කළහොත්, ජලයෙහි ඇල්ගී සෑදී එය කොළ පැහැයක් ගනී.
අඩු ක්ෂාරීයතාවයට හේතුව කුමක්ද?
තටාකයේ ජලයේ ක්ෂාරීය මට්ටමේ අනපේක්ෂිත පහත වැටීමක් පහත සඳහන් සාධක නිසා විය හැකිය:
- තටාක නඩත්තු කිරීමේදී නුසුදුසු නිෂ්පාදන (බහු කාර්යයන් සහිත ටැබ්ලට් භාවිතා කිරීමෙන් වළකින්න, ජලය ආම්ලික වේ).
- එක් සාධකයක් විය හැක්කේ තටාකයේ පෙරීමේ උපකරණ නිසි ලෙස ක්රියා නොකිරීමයි.
- උෂ්ණත්වයේ ප්රබල දේශගුණික වෙනස්කම් තිබේ නම්.
තටාක ක්ෂාරීය බව ඉහළ නැංවීම
තටාකයේ ක්ෂාරීය බව වැඩි කරන්නේ කෙසේද?

තටාකයේ ක්ෂාරීය බව වැඩි කරන්නේ කෙසේද?
ක්ෂාරීය බව ඉහළ නංවයි
තටාක ක්ෂාරීය බව වැඩි කිරීම: මෙය වඩාත් පොදු අවස්ථාවයි
නල ජලයේ ක්ෂාරීය බව සාමාන්යයෙන් ඉතා අඩු බැවින් (ස්පාඤ්ඤයේ ප්රදේශ කිහිපයක එය 10 හෝ 20 ppm තරම් අඩු අගයක් ගනී) මෙය වඩාත් සුලභ අවස්ථාවයි. තවද pH නියාමකයේ වඩාත් සුලභ නිවැරදි කිරීම ක්ලෝරීන් සමඟ වැඩිවෙමින් පවතින pH අගය අඩු කිරීම සහ pH අගය අඩු කිරීම සඳහා අපි අම්ලයක් මාත්රාවක් දමමු, එය ක්ෂාරීයතාවයද අඩු කරයි (pH අගයට වඩා බෙහෙවින් අඩු ප්රමාණයකට වුවද) .
ඔබේ තටාකයේ ජලයේ ක්ෂාරීය බව වැඩි කිරීම එය නැවත සමතුලිතතාවයට ගෙන ඒමේ පළමු පියවර වලින් එකක් විය හැකිය.
- ඔබේ ජලයේ අඩු pH අගයක් ඇති විට, එය ඔබේ තටාකයේ pH අගයට බලපාන අතර වළාකුළු පිරි ජලය සහ පැහැදිලි බවක් නොමැති වීම ඇතුළු ගැටලු කිහිපයක් ඇති කළ හැකිය. ඔබේ ජලයේ ක්ෂාරීය බව වැඩි කිරීමට, ඔබට ෙබ්කිං සෝඩා කුඩු හෝ ෙබ්කිං සෝඩා ස්ඵටික භාවිතා කළ හැකිය. ඔබේ තටාකය හෝ ස්පා සඳහා නිර්දේශිත ප්රමාණය පමණක් භාවිතා කිරීමට වග බලා ගන්න, අධික ලෙස ජලයේ pH අගයට අහිතකර බලපෑමක් ඇති කළ හැකිය. ඔබ ඔබේ ජලයේ පැහැදිලි බවේ වැඩි දියුණුවක් දැකීමට පටන් ගත් විට, ඒවා තිබිය යුතු තැන්වල රැඳී සිටින බවට වග බලා ගැනීම සඳහා ඔබේ ක්ෂාරීය මට්ටම් නිරීක්ෂණය කිරීමට ඔබට අවශ්ය වනු ඇත.
ක්ෂාරීය බයිකාබනේට් තටාකය වැඩි කරන්න
ක්ෂාරීය බව වැඩි කිරීම සඳහා ෙබ්කිං සෝඩා භාවිතා කිරීම වඩාත් සුදුසුය.
ඔබේ තටාකයේ ජලයේ ක්ෂාරීය බව වැඩි කිරීම එය නැවත සමතුලිතතාවයට ගෙන ඒමේ පළමු පියවර වලින් එකක් විය හැකිය. ඔබේ ජලයේ අඩු pH අගයක් ඇති විට, එය ඔබේ තටාකයේ pH අගයට බලපාන අතර වළාකුළු පිරි ජලය සහ පැහැදිලි බවක් නොමැතිකම ඇතුළු ගැටලු කිහිපයක් ඇති කළ හැකිය. ඔබේ ජලයේ ක්ෂාරීය බව වැඩි කිරීමට උපකාර කිරීම සඳහා, ඔබට ෙබ්කිං සෝඩා කුඩු හෝ ෙබ්කිං සෝඩා ස්ඵටික භාවිතා කළ හැකිය. ඔබේ තටාකය හෝ ස්පා සඳහා නිර්දේශිත ප්රමාණය පමණක් භාවිතා කිරීමට වග බලා ගන්න, අධික ලෙස ජලයේ pH අගයට අහිතකර බලපෑමක් ඇති කළ හැකිය. ඔබ ඔබේ ජලයේ පැහැදිලි බවෙහි වැඩි දියුණුවක් දැකීමට පටන් ගත් විට, ඒවා තිබිය යුතු තැන්වල රැඳී සිටින බවට වග බලා ගැනීම සඳහා ඔබේ ක්ෂාරීය මට්ටම් නිරීක්ෂණය කිරීමට ඔබට අවශ්ය වනු ඇත.
සෝඩියම් බයිකාබනේට් යනු සුදු කුඩු, ජලයේ විසුරුවා හැරීමට සහ හැසිරවීමට පහසුය, එය විශේෂයෙන් විෂ සහිත නොවන අතර ස්පර්ශ කළහොත් සමට හානි නොකරයි, එබැවින් එය මාත්රාව සහ තටාකයට වත් කිරීම පහසු වනු ඇත. මීට අමතරව, සෝඩියම් බයිකාබනේට් ජලයේ වයසට යෑමට හෝ විෂ වීමට දායක නොවේ (තවත් ලිපියකින් අපි වයස්ගත ජලය යන්නෙන් අදහස් කරන්නේ කුමක්ද යන්න ගැන කතා කරමු...).
සෝඩා අළු ද භාවිතා කළ හැකිය
, සහ කෝස්ටික් සෝඩා, නමුත් අපි එය නිර්දේශ නොකරමු, මන්ද ඒවා pH අගයට වඩා බොහෝ සෙයින් බාධා කරන අතර, එයින් අදහස් කරන්නේ pH අගයට අවම බලපෑමක් ඇතිව ක්ෂාරීයතාව ඉහළ නැංවීමට උත්සාහ කිරීමයි (එමගින් සම්පූර්ණ ක්රියාවලිය පහසු වේ) .
ඔබට අදහසක් ලබා දීම සඳහා, ක්ෂාරීය 10 ppm වැඩි කිරීම සඳහා, භාවිතා කරන ද්රව්යය මත pH අගය මත බලපෑම:
සෝඩියම් බයිකාබනේට්: pH අගය 0,017 වැඩි වේ
සෝඩියම් කාබනේට්: pH අගය 0,32 වැඩි වේ
කෝස්ටික් සෝඩා: pH අගය 0,6 කින් වැඩි වේ
මෙය ජලයේ ආම්ලිකතාවය මත ක්ෂාරීයත්වය ඇති කළ හැකි pH අගය වැඩි කිරීමේ බලපෑමට උදාහරණයකි. ඔබට අදහසක් ලබා දීම සඳහා, ක්ෂාරීය 10 ppm වැඩි කිරීම සඳහා, භාවිතා කරන ද්රව්යය මත pH අගය මත බලපෑම:
සෝඩියම් බයිකාබනේට්: pH අගය 0,017 වැඩි වේ
සෝඩියම් කාබනේට්: pH අගය 0,32 වැඩි වේ
කෝස්ටික් සෝඩා: pH අගය 0,6 කින් වැඩි වේ
මෙය ජලයේ ආම්ලිකතාවය මත ක්ෂාරීයත්වය ඇති කළ හැකි pH අගය වැඩි කිරීමේ බලපෑමට උදාහරණයකි. ඔබට අදහසක් ලබා දීම සඳහා, ක්ෂාරීය 10 ppm වැඩි කිරීම සඳහා, භාවිතා කරන ද්රව්යය මත pH අගය මත බලපෑම:
මට ෙබ්කිං සෝඩා කොපමණ අවශ්යද?
ඔබේ තටාකයේ සෑම m17,3කටම ක්ෂාරීය බව 10ppm කින් ඉහළ නැංවීමට ඔබට ෙබ්කිං සෝඩා ග්රෑම් 3ක් අවශ්ය වේ.
හෝ සමාන වන්නේ කුමක්ද:
ග්රෑම් වල ප්රමාණය = (අවශ්ය ක්ෂාරීයතාව - සැබෑ ක්ෂාරීයතාව) x (m3 තටාකය) x 1,73
සටහන: මෙම ගණනය කිරීම් ඇස්තමේන්තු වන අතර එක් තටාකයකින් තවත් සංචිතයකට වෙනස් විය හැකි බව මතක තබා ගන්න.
අපි 50 m3 තටාකයක් සඳහා උදාහරණයක් දෙන්නෙමු, වත්මන් ක්ෂාරීය මට්ටම 30 ppm වේ. මෙම අවස්ථාවේදී අපට 100 ppm වෙත ළඟා වීමට අවශ්ය වනු ඇත, එබැවින් අපට අවශ්ය වන්නේ:
(100 - 30) x 50 m3 x 1,73 = ෙබ්කිං සෝඩා ග්රෑම් 6055 (කිලෝ ග්රෑම් 6, රවුම් කිරීමට).
මම එය කළමනාකරණය කළ යුත්තේ කෙසේද?
පරමාදර්ශය වන්නේ ටිකෙන් ටික ගමන් කිරීමයි. සෑම දිනකම ඔබ තටාකයට දැමිය යුතු උපරිම රසායනික ද්රව්ය සඳහා න්යායික සූත්ර තිබේ. මෙම පරමාදර්ශී ලෝකයේ, 50 m3 තටාකයක උපරිම බයිකාබනේට් ප්රමාණය දිනකට ග්රෑම් 360 කි. නමුත් වෙලාවක් නැති නිසා බොහෝ විට එය කළ නොහැකි බව අපි දනිමු. බොහෝ තැන්වල තිබෙන ජලයෙන් ක්ෂාරීය බව නිවැරදි කිරීමට මාසයකට ආසන්න කාලයක් ගතවනු ඇත. නැත්නම් ඇල්ගී අයින් කරන අවස්ථාවක අපිට එච්චර කල් ගන්න බෑ.
එමනිසා, වෙනස්වීම් හැකි තරම් ක්රමයෙන් සිදුවන බව ජලයේ රසායන විද්යාව අගය කරන බැවින් ඔබට කාලය ඇති පරිදි ටිකෙන් ටික යාමට උත්සාහ කරන්න.
බයිකාබනේට් පරිපාලනය කිරීම සඳහා, ජලයේ තනුක, පෙරීම සක්රිය කර, සියලුම රසායනික ද්රව්ය මෙන් තටාකය පුරා බෙදා හරින්න. පැය 4-6 ක් පමණ පෙරීම තබන්න.
මෙම ක්රියාවලිය සිදු කරන අතරතුර pH නියාමකය අක්රිය කිරීමට නිර්දේශ කරනු ලැබේ. සෝඩියම් බයිකාබනේට් පරිපාලනය කිරීමෙන්, pH අගය ඉහළ යනු ඇත, නමුත් එය තාවකාලික වනු ඇත, පසුව එය ස්ථාවර වනු ඇත.
මෙම සම්පූර්ණ ක්රියාවලිය තුළ අපි pH අගය සඳහන් කර නැත. ක්ෂාරීය බව වැඩි කිරීමට අවශ්ය වූ විට, අපි එහි පරමාදර්ශී මට්ටම ස්ථාපිත කිරීම කෙරෙහි අවධානය යොමු කරමු, ඉන්පසු අපි ඊළඟට pH අගය මැනීම සහ සකස් කරමු.
ක්ෂාරීය බව වැඩි කිරීමට පෙර pH අගය වැඩි නම්, සෝඩියම් බයිකාබනේට් එය සැලකිය යුතු ලෙස වැඩි නොකරනු ඇත, මෙම ඉහළ pH අගය ක්ෂාරීයතාවයෙන් පසුව නිවැරදි කළ යුතුය.
තවද pH අගය අඩු නම්, ක්ෂාරීය බව වැඩි වන විට එය තරමක් ඉහළ යනු ඇත, නමුත් එය සකස් කිරීමට පෙර ඔබට සුදුසු මට්ටමක ක්ෂාරීය බව ලැබෙන තෙක් රැඳී සිටීම වඩා හොඳය. එසේම අඩු ක්ෂාරීය සමග, pH අගය ආරක්ෂා නොවන බව මතක තබා ගන්න, එය ඉහළ හෝ අඩු මට්ටම් මෙම ආරක්ෂාව නොමැතිකම නිසා විය හැක. 80 ත් 100 ත් අතර ක්ෂාරීයතාවයක් ඇති වන තෙක් බලා සිට pH අගය මැනීම සහ සකස් කිරීම සිදු වන්නේ එබැවිනි.
ක්ෂාරීය බව අඩු කරන්න
ක්ෂාරීය බව අඩු කිරීමට සිදු වීම සාමාන්ය දෙයක් නොවේ. සැපයුම් ජලය සාමාන්යයෙන් අඩු මට්ටමක පවතින නිසාත්, සාමාන්යයෙන් pH නියාමකයාට සෑම විටම pH අගය අඩු කළ යුතු නිසාත් (සහ අම්ල මාත්රාව ලබා දීමේදී ක්ෂාරීයතාවයේ අඩුවීමක් ද ඇත).
නමුත් සමහර භූගත ජලයේ මෙන්, සැපයුම ඉහළ pH අගය සහ ක්ෂාරීය බව සමඟ එන අවස්ථා තිබේ. එසේත් නැතිනම් ජලයට අසීමිත ලෙස රසායනික ද්රව්ය එකතු කර ප්රබල අසමතුලිතතා ඇති කරයි, ඒවායින් එකක් අධික ක්ෂාරීය බව.
pH අගය වැඩි හෝ අඩු නම් ක්ෂාරීයතාව අඩු කිරීම සඳහා ක්රමය වෙනස් වේ:
ඉහළ pH අගය සමඟ ක්ෂාරීයතාව අඩු කරන්න
එය ඉතා අපහසු වනු ඇති බැවින් pH අගය අඩු කිරීමට උත්සාහ නොකරන්න. අධික ක්ෂාරීයතාවයක් අම්ල උදාසීන කිරීමට ඉහළ බලයක් ඇත (එය භාෂ්මිකතාවයේ නිර්වචනයයි), අප එන්නත් කරන ඕනෑම අම්ලයක් pH අගයට ඉතා සුළු බලපෑමක් ඇති කරයි.
තවද මෙම අවස්ථා වලදී, තාක්ෂණය සමන්විත වන්නේ තටාකයේ පතුලේ (උදාහරණයක් ලෙස නලයක් සමඟ) හැකිතාක් දුරට කැටයම් (හයිඩ්රොක්ලෝරික් අම්ලය හෝ සල්ෆමන් හෝ මියුරියාටික් අම්ලය ලෙසද හැඳින්වේ) එන්නත් කිරීමෙනි. අපි හයිඩ්රොක්ලෝරික් අම්ලය හැකිතාක් සාන්ද්රණයෙන් භාවිතා කළ යුතුයි, බලාපොරොත්තු වන පරිදි 30%.
අපි අම්ලය එන්නත් කරන විට, අපජල පවිත්රාගාරය වසා දැමිය යුතු අතර, එය පසුදා වන තුරු එය ක්රියාත්මක නොවේ.
cc හි ඇති හයිඩ්රොක්ලෝරික් අම්ල ප්රමාණය සහ 30% අපට අවශ්ය වන්නේ:
1,55 x (තටාකයේ m3) x (වත්මන් ක්ෂාරීය කියවීම - අපේක්ෂිත ක්ෂාරීය මට්ටම)
50 m3 තටාකය පිළිබඳ අපගේ උදාහරණය සමඟින්, අපි 180 ppm ක්ෂාරීයතාවයකින් ආරම්භ කරමු යැයි උපකල්පනය කරමින්, 100 ppm ක්ෂාරීයත්වයට ළඟා වීමට අපට අවශ්ය වන්නේ:
1,55 x 50 x (180 – 100) = 6200 cc = 6,2% කැටයම් ලීටර් 30
සෑම දිනකම ක්ෂාරීයත්වය 40-50 ppm ට වඩා අඩු කිරීමට අප උත්සාහ නොකළ යුතුය. අවශ්ය නම්, එය සැසි කිහිපයකට බෙදන්න.
පැය 24 දී අපි ක්ෂාරීයත්වය සහ pH අගය මනිනු ලබන අතර, අපට අවස්ථා 3 ක් සොයාගත හැකිය:
- 80 සහ 120 අතර ක්ෂාරීයතාව, සහ pH පරාසය තුළ ද (ක්ලෝරීන් සහිත තටාක සඳහා ආසන්න වශයෙන් 7,5 ට අඩු, සහ බ්රෝමීන් සහිත තටාක සඳහා 7,8): මෙම නඩුවේදී අපි හරි, අපි ඉවරයි, එය පහසු විය.
- ක්ෂාරීයත්වය තවමත් 120 ට වැඩි, සහ pH අගය 7,2 ට වඩා වැඩි හෝ සමාන වේ. කැටයම් එන්නත් කිරීමේ ක්රියා පටිපාටිය අපට නැවත නැවතත් කළ හැකිය, නමුත් ක්ෂාරීය බව 10 සිට 10 ppm දක්වා අඩු කිරීමේ ඉලක්කය අප විසින්ම සකසා ගනිමු. මක්නිසාද යත්, pH අගය සීමාවට ආසන්න බැවින්, අපි බොහෝ දුර ගියහොත් එය පසුව ඉහළ නැංවීමට නොහැකි මට්ටමකට පහත වැටෙනු ඇත.
ඇත්ත වශයෙන්ම, ඕනෑම සැසියකදී pH අගය 7,0 ට වඩා පහත වැටේ නම්, අපි දිගටම කරගෙන නොයා යුතු අතර, අඩු pH අගයක් සහිත ක්ෂාරීයතාව අඩු කිරීමට පහත විස්තර කර ඇති ක්රමය යෙදීමට සිදුවේ. - ක්ෂාරීයතාව තවමත් ඉහළයි, නමුත් pH අගය 7,0 - 7,2 ට අඩුයි: අපි දිගටම කරගෙන නොයා යුතුය, අඩු pH අගයකින් ක්ෂාරීයතාව අඩු කිරීමේ තාක්ෂණය යෙදිය යුතුය.
අඩු pH අගය සමඟ ක්ෂාරීය බව අඩු කරන්න
pH අගය අඩු වූ විට සහ ක්ෂාරීයතාව ඉහළ මට්ටමක පවතින විට, එය නරකම අවස්ථාවයි, මන්ද ශේෂය යථා තත්ත්වයට පත් කිරීම වඩාත් අපහසු වන අවස්ථාව මෙයයි. අපි අම්ලය යෙදුවොත්, pH අගය තවත් පහත වැටෙනු ඇත, එවිට එය සමතුලිත කිරීමට අපට පදනම් සැපයීමට සිදුවනු ඇත, නමුත් ඒවා නැවත ක්ෂාරීයත්වය ඉහළ නංවන අතර අපි ලූපයකට ඇතුල් වේ. pH අගය සහ භාෂ්මිකතාවය සෑම විටම පාහේ එකම දිශාවකට වෙනස් කර ඇති බව මතක තබා ගන්න, එබැවින් ඒවා ප්රතිවිරුද්ධ දිශාවට ධාවනය කිරීම පැහැදිලි නැත.
pH අගය වැඩි වීමත් සමඟ pH අගය වැඩි කළ නොහැකි බැවින් (ක්ෂාරීයතාව වැඩි වන නිසා), එවිට අපි වාතනය ලෙස හැඳින්වෙන ක්රමයක් භාවිතා කළ යුතුය, එමඟින් ජලය භෞතික ක්රියාවලියකට "එන්නත්" කරන අතර එමඟින් එහි ද්රාවිත වායූන් නැති වේ. විශේෂයෙන් කාබන් ඩයොක්සයිඩ් (CO2 ) වැඩි රසායනික විශ්ලේෂණයකට නොගොස්, CO විසුරුවා හැරීමෙන් බව කියන්න2 ජලයේ එහි pH අගය අඩු වන අතර, අපි එය ජලයෙන් අඩු කිරීමට සමත් වුවහොත්, අපි එය වැඩි කරන්නෙමු.
ඔබ නිවැරදිව කියවා ඇත, ජලය හොඳින් වාතනය කිරීමෙන් අපි CO ඉවත් කිරීමට කළමනාකරණය කරමු2 කිසිදු රසායනික ද්රව්යයක් එකතු නොකර එහි pH අගය වැඩි කිරීම භෞතික ක්රියාවලියකි.
ඔබට සිතිය හැකි ඕනෑම දෙයක් ජලය වාතනය කිරීමට ක්රම කිහිපයක් තිබේ. ඔබට කුඩා සුළියක් ජනනය කිරීමට තෙරපුම් දිශානතියට පත් කළ හැකිය, නමුත් බලපෑම කුඩා වේ. ඔබට මුළු රාත්රිය පුරාම විසිර යා හැකිය ... නමුත් වඩාත්ම ප්රයෝජනවත් දෙය නම් ඔබ කුඩා “උල්පතක්” සෑදීමයි: PVC පයිප්පයක් සහ වැලමිට කිහිපයක් සමඟ ඔබ ජිරාෆ් වර්ගයක් සාදන්න; ඔබ එක් කෙළවරක ප්රේරකයකට සම්බන්ධ කරන අතර අනෙක් කෙළවරේ ඔබ කුඩා සිදුරු සාදන PVC ප්ලග් එකක් දමන්න, එය ෂවර් හිසක් මෙන්. පහළ වැලමිට අංශක 45 ක් විය හැකි අතර එමඟින් ඔවුන් ජලය වඩාත් කෙලින්ම තටාකයට "ප්ලග්" කරයි.
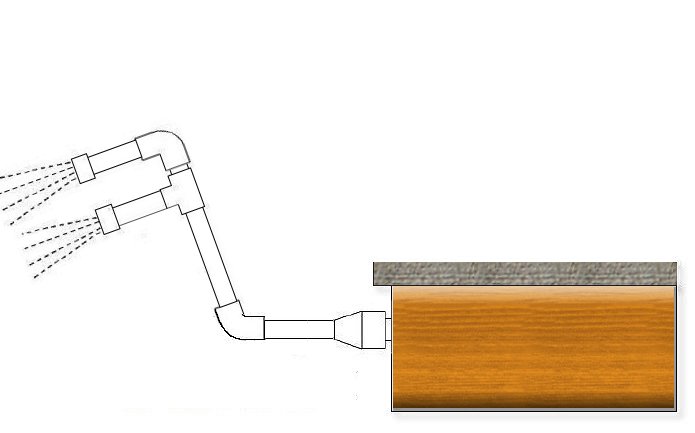
ඔබ පෙරීම සක්රිය කරන්න, පීඩනය වැඩි වන පරිදි ඔබට අනෙකුත් ප්රේරක ආවරණය කළ හැකි නම්, වඩා හොඳය. ක්රියාත්මක වීමට පැය ගණනක් අවශ්ය වේ, එය තටාකයේ ප්රමාණය සහ pH මට්ටම මත රඳා පවතී, නමුත් ඔබට එය පැය 6-8 කට නොඅඩු කාලයක් ධාවනය කිරීමට සිදුවේ. තවද pH අගය මදක් ඉහල ගොස් ඇති බව ඔබට පෙනෙනු ඇත.
වැලමිට සහ පයිප්ප ලබා ගැනීම පහසුය, සමහර විට එය ප්රේරකයට සම්බන්ධ කරන්නේ කෙසේද යන්න වඩා දුෂ්කර ය. ඔබේ තටාක ප්රේරක සාමාන්ය සුදු ABS ඒවා නම් ඉස්කුරුප්පු තොප්පියක් සහිත නම්, ඔබට පහත කොටස සමඟ 32mm PVC පයිප්පයකට සම්බන්ධ විය හැක:

අපි pH අගය 7,2 දක්වා ඉහළ නැංවීමට සමත් වූ පසු, ක්ෂාරීය බව අඩු කිරීම සඳහා අපි හයිඩ්රොක්ලෝරික් අම්ලය නැවත එන්නත් කරමු. ක්ෂාරීයතාව වැඩි ප්රමාණයක් නිවැරදි කළ හැකි බැවින්, අපි pH අගය ඉහළ නංවා ඇති තරමට වඩා හොඳය. අපට එය 7,6 දක්වා ඉහළ නැංවිය හැකි නම්, සියල්ල වඩා හොඳය. pH අගය 7,0 - 7,2 ට වඩා අඩු කරන ක්ෂාරීය නිවැරදි කිරීමක් කිරීමට ඔබට අවශ්ය නොවන බව මතක තබා ගන්න.
වැදගත් සටහනක්: ඔව්, ඔව්, ඔබ දැනගත් පරිදි, දිය ඇලි, දිය ඇලි, ආදිය. තටාකවල ඔවුන් නැත «අහිංසකයි“…. pH අගය ඉහළ නැංවීමට සෘජු බලපෑමක් ඇති කරයි, එබැවින් එහි භාවිතය (හෝ අපයෝජනය) කොන්දේසි අනුව contraindicated විය හැක...
තටාක ක්ෂාරීය වැඩි කරන්නා මිලදී ගන්න
තටාක ක්ෂාරීය වැඩි කරන මිල
[amazon box= «B071458D86, B07CLBJZ8J , B071458D86, B08TC3DZZD» button_text=»මිලදී ගන්න» ]
තටාකයේ ජල ක්ෂාරීය මීටරය

ක්ෂාරීයත්වය මැනීම සඳහා මිනුම්: විශ්ලේෂණ තීරු.
ජලයේ සම්පූර්ණ ක්ෂාරීයතාවය මැනීම සඳහා, ඔබට සරල විශ්ලේෂණ තීරු (පරාමිතීන් 4 හෝ 7 ක් මැනීම) වෙත යොමු විය හැකි අතර එමඟින් එහි අගය ඉක්මනින් හා පහසුවෙන් සොයා ගැනීමට ඔබට ඉඩ සලසයි. ඒ හා සමානව, ඔබට විවිධාකාර ඩිජිටල් මීටර හෝ ෆොටෝමීටර සමඟ මිනුම් සිදු කළ හැකිය.
තටාක ක්ෂාරීය බව මැනීමට නිෂ්පාදන මිලදී ගන්න
ක්ෂාරීයතාව සාමාන්යයෙන් මනිනු ලබන්නේ pH මීටරයකින් වන අතර එමඟින් පරීක්ෂා කරන ද්රවයේ pH හි වෙනස්කම් හඳුනා ගනී.
පිහිනුම් තටාක සඳහා ක්ෂාරීය පරීක්ෂණය
HOMTIKY ජල තීරු 6 IN1 50PCS
මෙම නිෂ්පාදනයේ පෙනුම තුනී තීරුවක් වන අතර, හඳුනාගැනීමේ බ්ලොක් වල එක් කෙළවරක් විද්යාත්මක දුර ප්රමාණය අනුව සකස් කර ඇති අතර අනෙක් කෙළවර අතින් පිහිටීම සඳහා වේ. මෙම නිෂ්පාදනයේ එක් පරීක්ෂණ තීරුවකට නියැදියේ ඇති වැදගත් අංග හයක් එකවර හඳුනාගත හැකිය. තත්පර 30 ක් ඇතුළත, සම්පූර්ණ දෘඪතාව, නිදහස් අවශේෂ ක්ලෝරීන්, සම්පූර්ණ ක්ලෝරීන්, සයනුරික් අම්ලය, සම්පූර්ණ ක්ෂාර සහ සාම්පල ජලයේ pH අගය හඳුනාගත හැකිය.
තටාක ක්ෂාරීය පරීක්ෂණය භාවිතා කරන්නේ කෙසේද
භාවිතා කිරීමට පහසු තටාක ක්ෂාරීය පරීක්ෂණය
 |  |  |
|---|---|---|
| පිහිනුම් තටාකයේ pH පරීක්ෂණ තීරු එය සම්පූර්ණ ක්ලෝරීන්, නිදහස් ක්ලෝරීන්, pH අගය, සම්පූර්ණ ක්ෂාරීයත්වය, සයනුරික් අම්ලය සහ සම්පූර්ණ දෘඪතාව මැනීම සඳහා නිර්මාණය කර ඇත. | BottleEach විවෘත කරන්න, අද්විතීය කෑලි 10 ක් තෙතමනයෙන් ආරක්ෂා කර ඇති පිටත ඇලුමිනියම් ඇසුරුමක ඇත. | පරීක්ෂණ තීරුව ඉවතට ගන්න පරීක්ෂණ තීරුව පිටතට ගෙන භාවිතයෙන් පසු බෝතල් මූඩිය තදින් වසා දමන්න. |
 |  |  |
|---|---|---|
| එය වතුරේ ගිල්වන්න පරීක්ෂණ තීරුවේ පාට කොටස වතුරේ ගිල්වා තත්පර 2 කට පසු එය අදින්න. | තත්පර 30 ක් රැඳී සිටින්න, පරීක්ෂණ තීරුව තබා තත්පර 30 ක් රැඳී සිටින්න. | ප්රතිඵල බලන්න බෝතලයේ ඇති වර්ණ කාඩ්පතට පරීක්ෂණ තීරුව සසඳා නිවැරදි ප්රතිඵල සඳහා තත්පර 30ක් ඇතුළත කියවීම සම්පූර්ණ කරන්න |
හඳුනාගැනීමේ මූලද්රව්ය පිළිබඳ විස්තරය
සම්පූර්ණ දෘඪතාව
සම්පූර්ණ තද බව යනු ජලයේ ඇති කැල්සියම් සහ මැග්නීසියම් ප්රමාණයයි. තටාකයේ සහ ස්පා ජලයේ සම්පූර්ණ දෘඪතාව 250 සහ 500 mg/L අතර විය යුතුය.
නිදහස් අවශේෂ ක්ලෝරීන්, සම්පූර්ණ ක්ලෝරීන්
ක්ලෝරීන් යනු තටාකයේ සහ ස්පා ජලයේ බහුලව භාවිතා වන විෂබීජ නාශක වන අතර, එහි මූලික අරමුණ වන්නේ ජලයේ ඇති අපවිත්ර ද්රව්ය විෂබීජහරණය කිරීම සහ ඔක්සිකරණය කිරීම, එමඟින් පිහිනන්නන් සඳහා ආරක්ෂාව සැපයීමයි. ක්රියාකාරී තටාක ඇති සහ ජලයේ ඇති අපවිත්ර ද්රව්ය ඔක්සිකරණය කිරීමේ හැකියාව ඇති ක්ලෝරීන් නිදහස් අවශේෂ ක්ලෝරීන් ලෙස හැඳින්වේ. දූෂක සමඟ ප්රතික්රියා කිරීමෙන් එහි විෂබීජ නාශක බලය අවසන් වූ ක්ලෝරීන් ඒකාබද්ධ ක්ලෝරීන් ලෙස හැඳින්වේ. සම්පූර්ණ ක්ලෝරීන් යනු අවශේෂ නිදහස් ක්ලෝරීන් සහ බැඳුනු ක්ලෝරීන් එකතුවයි. තටාකයේ ඇති නිදහස් අවශේෂ ක්ලෝරීන් 0,3 සහ 1 mg/L අතර විය යුතු අතර, තාපජ ජලයේ නිර්දේශිත නිදහස් අවශේෂ ක්ලෝරීන් 3 සහ 5 mg/L අතර විය යුතුය.
සයනුරික් අම්ලය
සයනුරික් අම්ලය, "ස්ථායීකාරක" හෝ "කන්ඩිෂනර්" ලෙසද හැඳින්වේ, සූර්යයාගේ පාරජම්බුල කිරණවලට නිරාවරණය වන විට ක්ලෝරීන් වඩාත් ස්ථායී කරයි. ක්ලෝරීන් සංයෝග දෙකක (ඩයොක්සි සහ ට්රයිඔක්සි) දැනටමත් සයනුරික් අම්ලය අඩංගු වේ. මෙම ඕනෑම විෂබීජ නාශකයක් අඛණ්ඩව භාවිතා කිරීමෙන් සයනුරික් අම්ලය මට්ටම වැඩි කළ හැකිය. සයනුරික් අම්ලයේ අන්තර්ගතය 50 mg/L ට වඩා අඩු හෝ සමාන විය යුතුය.
ශ්රේණි:
සයනුරික් අම්ල පරීක්ෂණ ප්රතිඵල ලබා ගැනීම සඳහා pH අගය 7.0-8.4 අතර විය යුතු අතර සම්පූර්ණ ක්ෂාරීයතාවය 240 mg/L ට වඩා අඩු හෝ සමාන විය යුතුය.
සම්පූර්ණ ක්ෂාර
සම්පූර්ණ ක්ෂාරීයත්වය යනු ජලයේ ඇති ක්ෂාරීය ද්රව්ය (ප්රධාන වශයෙන් බයිකාබනේට් සහ කාබනේට්) ප්රමාණය මැනීමකි. සෝඩියම් ක්ලෝරයිඩ්, සෝඩියම් ට්රයික්ලෝරයිඩ් හෝ ආලේපන විෂබීජ නාශකයක් ලෙස භාවිතා කරන්නේ නම්, සම්පූර්ණ ක්ෂාරීයත්වය 100 සිට 120 mg/L පරාසයක තිබිය යුතුය. විෂබීජ නාශකයක් ලෙස කැල්සියම්, සෝඩියම් හෝ ලිතියම් හයිපොක්සයිඩ් භාවිතා කරන්නේ නම්, සම්පූර්ණ ක්ෂාරීය මට්ටම 80 සිට 100 mg / L පරාසයක තිබිය යුතුය.
PH
pH යනු ජලයේ ඇති ආම්ලික හෝ ක්ෂාරීය ද්රව්යවල ශක්තියයි. pH 7,0 මධ්යස්ථ වන අතර තටාකයේ සහ ස්පා ජලයේ pH පරාසය 7,0 සහ 7,8 අතර විය යුතුය.

සටහන්:
1. තෙත් ඇඟිලි බෝතලය තුළට දමන්න එපා.
2. ඔබේ දෑතින් පරීක්ෂණ තීරු පරීක්ෂණ කුට්ටිය ස්පර්ශ කිරීම හෝ දූෂණය නොකරන්න.
3. එක් එක් පරීක්ෂණ තීරු ඉවත් කිරීමෙන් පසු තොප්පිය තද කරන්න.
4. කියවීමක් ලබා ගැනීම සඳහා හොඳ ආලෝකයේ ඇති පරීක්ෂණ තීරුවේ වර්ණය සසඳන්න.
5. සිසිල්, වියලි සහ අඳුරු තත්ත්වයේ ගබඩා කරන්න.
6. විවෘත කිරීමෙන් පසු දින 90 ක් ඇතුළත පරිභෝජනය කිරීම රෙකමදාරු කරනු ලැබේ.
රසායනික ප්රතික්රියාකාරක භාවිතය සඳහා පූර්වාරක්ෂාව:
1. තටාකය භාවිතා කරන විට රසායනික ප්රතික්රියාකාරක එකතු නොකරන්න.
2. අම්ලය එකතු කිරීමේදී ජලයට අම්ලය එකතු කළ යුතු නමුත් අම්ලයට ජලය එකතු නොකළ යුතුය.
3. සියලුම රසායනික ප්රතික්රියාකාරක ප්රවේශමෙන් භාවිතා කළ යුතු අතර භාවිතය සඳහා උපදෙස් දැඩි ලෙස අනුගමනය කළ යුතුය.
තටාක ක්ෂාරීය පරීක්ෂණය මිලදී ගන්න
තටාක ජල ක්ෂාරීය පරීක්ෂණ තීරු මිල
තටාක ක්ෂාරීය බව මැනීමට ලිපියක් මිලදී ගන්න


