
பக்க உள்ளடக்கங்களின் அட்டவணை
En சரி பூல் சீர்திருத்தம், இந்த பிரிவில் உள்ள pH நிலை நீச்சல் குளங்கள் நாங்கள் சிகிச்சை செய்வோம் குளத்தின் நீர் மதிப்புகளில் ph மற்றும் poh இடையே உள்ள வேறுபாடு.
ஒரு குளத்தில் pH என்ன, அதன் அளவுகள் எப்படி இருக்க வேண்டும்?

நீச்சல் குளங்களுக்கு சிறந்த pH என்றால் என்ன (7,2-7,4)
சுருக்கமான pH என்பது சாத்தியமான ஹைட்ரஜனைக் குறிக்கிறது மற்றும் இது தண்ணீரின் அமிலத்தன்மை அல்லது அடிப்படைத் தன்மையைக் குறிக்கும் அளவீடு ஆகும்.
பின்னர், pH என்பது ஹைட்ரஜனின் திறனைக் குறிக்கிறது, இது உங்கள் குளத்தில் உள்ள நீரில் உள்ள ஹைட்ரஜன் அயனிகளின் செறிவுடன் ஒத்திருக்கும் ஒரு மதிப்பு, எனவே நீரின் அமிலத்தன்மை அல்லது அடிப்படைத்தன்மையின் அளவைக் குறிக்கும் குணகம். எனவே, தண்ணீரில் உள்ள H+ அயனிகளின் செறிவைக் குறிக்கும் பொறுப்பில் pH உள்ளது, அதன் அமிலத்தன்மை அல்லது அடிப்படைத் தன்மையைத் தீர்மானிக்கிறது.
நீச்சல் குளத்தின் நீரின் pH மதிப்புகளின் அளவு


குளத்து நீரின் pH அளவீட்டில் என்ன மதிப்புகள் அடங்கும்?
- pH அளவீட்டு அளவில் 0 முதல் 14 வரையிலான மதிப்புகள் உள்ளன.
- குறிப்பாக 0 மிகவும் அமிலமானது, 14 மிக அடிப்படையானது மற்றும் நடுநிலை pH ஐ 7 இல் வைக்கிறது.
- இந்த அளவீடு பொருளில் உள்ள இலவச ஹைட்ரஜன் அயனிகளின் (H+) எண்ணிக்கையால் தீர்மானிக்கப்படுகிறது.

நமக்கு ஏன் pH தேவை?
pH என்பது அக்வஸ் கரைசலின் அமிலத்தன்மை அல்லது அடிப்படைத் தன்மையைக் குறிப்பிடப் பயன்படும் அளவீடு ஆகும். ஒரு அக்வஸ் கரைசல் அமிலமாக அல்லது அடித்தளமாக வினைபுரிகிறதா என்பது அதன் ஹைட்ரஜன் அயனிகளின் (H+) உள்ளடக்கத்தைப் பொறுத்தது.
இருப்பினும், வேதியியல் ரீதியாக தூய மற்றும் நடுநிலை நீர் கூட நீரின் சுய-விலகல் காரணமாக சில ஹைட்ரஜன் அயனிகளைக் கொண்டுள்ளது.
நிலையான நிலையில் (750 mmHg மற்றும் 25°C) சமநிலையில், 1 லிட்டர் தூய நீர் உள்ளது என்பது அறியப்படுகிறது. மோல்
y
மோல்
அயனிகள், எனவே, நிலையான வெப்பநிலை மற்றும் அழுத்தத்தில் உள்ள நீர் (STP) pH 7 ஐக் கொண்டுள்ளது.
எங்கள் குளத்தின் pH கட்டுப்படுத்தப்படாவிட்டால் என்ன செய்வது

அதிக pH பூல் விளைவுகள் மற்றும் உங்கள் குளத்தில் pH அதிகமாக இருப்பதற்கான காரணங்களை அறிந்து கொள்ளுங்கள்

குளத்தின் pH ஐ எவ்வாறு உயர்த்துவது மற்றும் அது குறைவாக இருந்தால் என்ன ஆகும்

உயர் அல்லது அல்கலைன் பூல் pH ஐ எவ்வாறு குறைப்பது
pH உடன் கூடுதலாக குளத்தை எவ்வாறு பராமரிப்பது என்பது குறித்த வழிகாட்டுதல்கள்: தண்ணீரை சுத்தம் செய்தல் மற்றும் கிருமி நீக்கம் செய்தல்

ஒரு குளத்தை எவ்வாறு சுத்தம் செய்வது என்பதை அறிய பயனுள்ள வழிகாட்டி

சரியான நிலையில் தண்ணீருடன் ஒரு குளத்தை பராமரிப்பதற்கான வழிகாட்டி
அமில, நடுநிலை மற்றும் கார pH மதிப்புகள்
pH மதிப்புகளின் அளவின் வகைப்பாடு
pH மதிப்புகள் என்ன

pH அளவுகோல் 1 முதல் 14 வரை செல்கிறது, pH 7 ஒரு நடுநிலை தீர்வு.
எனவே, pH என்பது 0 (அதிக அமிலத்தன்மை) மற்றும் 14 (அதிக கார) மதிப்புகளுக்கு இடையே மடக்கை அளவில் வெளிப்படுத்தப்படும் ஒரு மதிப்பு என்று மாறிவிடும்; இடையில் நடுநிலையாக பட்டியலிடப்பட்டுள்ள மதிப்பு 7ஐக் காண்கிறோம்.
pH அளவிலான உலகளாவிய pH காட்டி
ஒரு பொருள் அமில அல்லது கார pH அளவைக் கொண்டுள்ளது என்றால் என்ன?
அமிலங்கள் மற்றும் அமிலங்கள் என்றால் என்ன?
அமிலங்கள் மற்றும் காரங்கள் இயற்கையில் இருக்கும் பொருட்கள் மற்றும் அவற்றின் pH அளவு, அதாவது அமிலத்தன்மை அல்லது காரத்தன்மையின் அளவு ஆகியவற்றால் வேறுபடுகின்றன. பொருட்கள் அமிலமா அல்லது காரமா என்பதை தீர்மானிப்பது pH அளவின் மூலம் அளவிடப்படும் அமிலத்தன்மை அல்லது காரத்தன்மையின் அளவின் மூலம் நிர்வகிக்கப்படுகிறது மற்றும் 0 (அதிக அமிலத்தன்மை 14 (அதிக கார) வரை இருக்கும். இருப்பினும், இவை இரண்டும் பொதுவாக அரிக்கும், பெரும்பாலும் நச்சுத்தன்மையுள்ள பொருட்கள் இருப்பினும் பல தொழில்துறை மற்றும் மனித பயன்பாடுகள் உள்ளன.
அமிலப் பொருட்கள் என்றால் என்ன?
- அமில pH நிலை: pH 7 க்கும் குறைவானது
pH மதிப்பு அமிலமானது என்றால் என்ன?
- ஒரு பொருள் அமிலமானது என்றால் அதில் எச் அதிகம் உள்ளது+ (ஹைட்ரஜன் அயனிகள்): pH 7 ஐ விட அதிகம்
- எனவே, அமிலங்கள் pH 7 க்கும் குறைவான பொருட்கள். (நீரின் pH 7 க்கு சமம், நடுநிலையாகக் கருதப்படுகிறது), அதன் வேதியியல் பொதுவாக தண்ணீரைச் சேர்க்கும்போது அதிக அளவு ஹைட்ரஜன் அயனிகளைக் கொண்டுள்ளது. அவை பொதுவாக புரோட்டான்களை இழப்பதன் மூலம் மற்ற பொருட்களுடன் வினைபுரிகின்றன (எச்+).
நடுநிலை பொருட்கள் என்றால் என்ன?
- நடுநிலை pH மதிப்பு: pH சமம் 7-
pH மதிப்பு நடுநிலையானது என்றால் என்ன?
- pH என்பது நீர் எவ்வளவு அமிலம்/அடிப்படையானது என்பதற்கான அளவீடு ஆகும்.
- வரம்பு 0 முதல் 14 வரை, 7 நடுநிலையாக உள்ளது.
காரப் பொருட்கள் என்றால் என்ன?
- அடிப்படை அல்லது கார pH கொண்ட பொருட்கள்: pH 7 ஐ விட அதிகமாக உள்ளது.
pH மதிப்பு காரமாக இருந்தால் என்ன அர்த்தம்?
- ஒரு பொருள் காரமானது என்றால் அது H இல் குறைவாக உள்ளது என்று அர்த்தம்+ (அல்லது ஓஹெச் தளங்கள் நிறைந்தவை-, இது H ஐ நடுநிலையாக்குகிறது+).
- இதற்கெல்லாம், மறுபுறம், அடிப்படைகள், pH 7 ஐ விட அதிகமாக உள்ள பொருட்கள்., இது அக்வஸ் கரைசல்களில் பொதுவாக ஹைட்ராக்சில் அயனிகளை வழங்குகிறது (OH-) மத்தியில். அவை சக்திவாய்ந்த ஆக்ஸிஜனேற்றிகளாக இருக்கின்றன, அதாவது அவை சுற்றியுள்ள ஊடகத்திலிருந்து புரோட்டான்களுடன் வினைபுரிகின்றன.
pH மற்றும் pOH மதிப்புகளுக்கு இடையே உள்ள வேறுபாடுகள்

அவை எவ்வாறு தொடர்புடையவை மற்றும் ph மற்றும் poh அளவீடுகளுக்கு இடையிலான வேறுபாடுகள் என்ன?
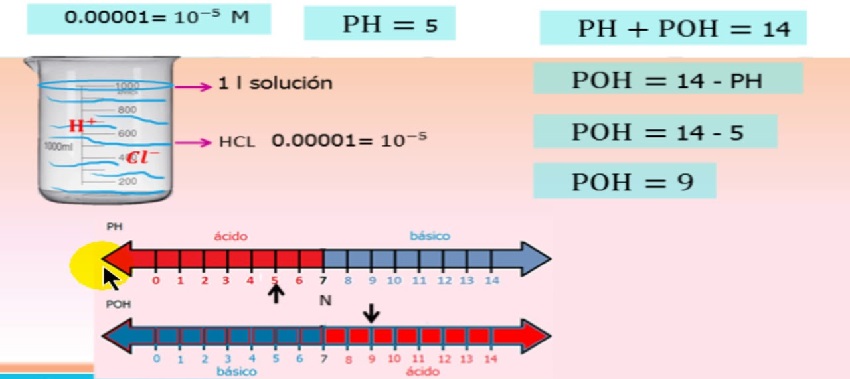
நிச்சயமாக, அயனிகளின் செயல்பாடு அயனி செறிவைப் பொறுத்தது மற்றும் இது சமன்பாட்டில் விவரிக்கப்பட்டுள்ளது
pH/poH அயன் செயல்பாடு சமன்பாடு
எங்கே, - ஹைட்ரஜன் அயன் செயல்பாடு
- ஹைட்ரஜன் அயனியின் செயல்பாட்டுக் குணகம்
- ஹைட்ரஜன் அயனி செறிவு
செயல்பாட்டுக் குணகம் என்பது அயனிச் செறிவு மற்றும் தீர்வு மேலும் மேலும் நீர்த்துப்போகும்போது 1ஐ நெருங்குகிறது.
நீர்த்த (சிறந்த) தீர்வுகளுக்கு, கரைப்பானின் நிலையான நிலை 1,00 M ஆகும், எனவே அதன் மோலாரிட்டி அதன் செயல்பாட்டிற்கு சமம்.
எனவே, சிறந்த தீர்வுகளைக் கருதும் பெரும்பாலான சிக்கல்களுக்கு, மோலார் செறிவின் அடிப்படை 10 க்கு மடக்கையைப் பயன்படுத்தலாம், செயல்பாடு அல்ல.
pH மற்றும் pOH இன் மதிப்புக்கு இடையே உள்ள வேறுபாடுகள்

சாதாரண pH மதிப்பு என்ன?
- ஒரு வகையில், pH என்பது ஒரு அளவீடு ஆகும் ஒரு கரைசலின் அமிலத்தன்மை அல்லது காரத்தன்மையின் அளவை நிறுவ பயன்படுகிறது. "p" என்பது "சாத்தியம்" என்பதைக் குறிக்கிறது, அதனால்தான் pH அழைக்கப்படுகிறது: ஹைட்ரஜனின் திறன்.
pOH மதிப்பு என்ன?
- உங்கள் பங்கிற்கு. pOH என்பது ஒரு கரைசலில் உள்ள ஹைட்ராக்சில் அயனிகளின் செறிவின் அளவீடு ஆகும். இது ஹைட்ராக்சில் அயன் செறிவின் அடிப்படை 10 எதிர்மறை மடக்கையாக வெளிப்படுத்தப்படுகிறது மற்றும் pH போலல்லாமல், கரைசலின் காரத்தன்மை அளவை அளவிட பயன்படுகிறது.

pH அல்லது pOH மதிப்பு எவ்வாறு கணக்கிடப்படுகிறது?
ph அளவிலான மதிப்புகளுக்கான சூத்திரம் என்ன?
- இது ஏற்கனவே அறியப்பட்டபடி, அறிவியல் துறையில், தி pH அளவீடு ஆகும் de உள்ளே உள்ள அயனிகள் de ஒரு தீர்வு. நீங்கள் செய்ய வேண்டியிருக்கலாம் pH ஐ கணக்கிடுங்கள் செறிவு அடிப்படையில். கணக்கிடுங்கள் pH என்ற சமன்பாட்டைப் பயன்படுத்துதல் pH: pH = -log[H3O+].
pOH ஐ கணக்கிடுவதற்கான சூத்திரம் என்ன?
- மேலும், pOH (அல்லது OH சாத்தியம்) என்பது ஒரு தீர்வின் அடிப்படை அல்லது காரத்தன்மையின் அளவீடு ஆகும். மேலும் se pH ஐப் பயன்படுத்துகிறது = – பதிவு [H3O+ஹைட்ரோனியம் அயனிகளின் செறிவை அளவிட [H3O+].

pH அல்லது pOH மதிப்பைக் கணக்கிடுவதற்கான முக்கிய சமன்பாடுகள்
- pH=−log[H3O+]
- pOH=-பதிவு[OH−]
- [H3O+] = 10-pH
- [ஓ-] = 10-pOH
- pH + pOH =pKw = 14.00 25 °C.
pH மதிப்புகளின் அளவிற்கும் pOH இன் அளவிற்கும் என்ன வித்தியாசம்?
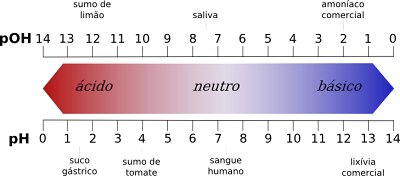
pH அளவின் மதிப்புகளுக்கு இடையிலான ஏற்றத்தாழ்வுகள்
- ஒருபுறம், pH அளவுகோல் அமில மதிப்புகளை 1 முதல் 6 வரை கொடுக்கிறது, அதே நேரத்தில் pOH அளவுகோல் 8 முதல் 14 வரை அமில மதிப்புகளை வழங்குகிறது.
- மாறாக, pH அளவுகோல் 8 முதல் 14 வரையிலான அடிப்படை மதிப்புகளைக் கொடுக்கிறது, அதே நேரத்தில் pOH அளவுகோல் 1 முதல் 6 வரையிலான அடிப்படை மதிப்புகளைக் கொடுக்கிறது.
ph மற்றும் pOH அவற்றின் மதிப்புகளுடன் மடக்கை அளவிலான உறவு
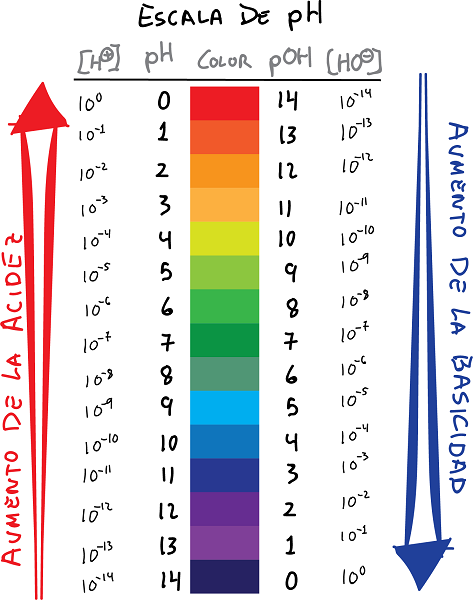
நிறங்கள் மற்றும் மதிப்புகளுடன் ph மற்றும் pOH அளவிலான இணைப்பு
- pH H அயனிகளின் செறிவின் மடக்கை ஆகும்+, அடையாளம் மாற்றப்பட்டது:
- இதேபோல், வரையறுக்கவும் pOH OH அயன் செறிவின் மடக்கையாக-, அடையாளம் மாற்றப்பட்டது: இடையே பின்வரும் உறவை ஏற்படுத்தலாம் pH மற்றும் pOH.
- அடிப்படையில், pH மதிப்புகள் ஹைட்ரஜன் அயன் செறிவின் எதிர்மறை மடக்கையைக் கொடுக்கின்றன, அதே நேரத்தில் pOH மதிப்பு ஹைட்ராக்சைடு அயனி செறிவின் எதிர்மறை மடக்கையைக் கொடுக்கிறது.
pH மற்றும் pOH மதிப்புகளுக்கு இடையே உள்ள வேறுபாடு
ph மதிப்பு அட்டவணைக்கும் pOH மதிப்புக்கும் இடையே உள்ள முரண்பாடுகள்
அதன் பிறகு, pH ஆனது ஹைட்ரஜன் அயனிகளின் செறிவுகளை அளவிடும் அதே வேளையில், pH ஆனது ஹைட்ராக்சில் அனான்கள் அல்லது ஹைட்ராக்சைடு அயனிகளின் செறிவுகளை அளவிடும் ஒரு திரைப்படத்தை நாங்கள் உங்களுக்கு வழங்குகிறோம்.


