
Index vun Säit Inhalt
En Ok Pool Reform, an dëser Rubrik bannent der pH Niveau Schwämm mir wäerten de behandelen Ënnerscheed tëscht ph a Poh am Poolwaasserwäerter.
Wat ass de pH an engem Pool a wéi soll seng Niveauen sinn?

Wat heescht den ideale pH fir Schwämm (7,2-7,4)
Den Akronym pH steet fir potenziell Waasserstoff an ass eng Moossnam déi d'Aciditéit oder d'Basisitéit vum Waasser uginn.
Also, De pH bezitt sech op d'Potenzial vu Waasserstoff, e Wäert deen der Konzentratioun vu Waasserstoffionen am Waasser an Ärem Pool entsprécht an ass dofir de Koeffizient deen de Grad vun der Aciditéit oder der Basisheet vum Waasser uginn. Dofir ass de pH verantwortlech fir d'Konzentratioun vun H + Ionen am Waasser ze weisen, seng sauer oder Basis Charakter ze bestëmmen.
Skala vun pH Wäerter vum Schwämm Waasser


Wéi eng Wäerter enthält de Poolwaasser pH Miessskala?
- D'PH Miessskala enthält Wäerter vun 0 bis 14.
- Besonnesch 0 ass am sauersten, 14 am meeschte Basis a setzt den neutralen pH op 7.
- Dës Miessung gëtt duerch d'Zuel vu fräie Waasserstoffionen (H+) an der Substanz bestëmmt.

Firwat brauche mir pH?
pH ass eng Moossnam benotzt fir d'Aciditéit oder d'Basisitéit vun enger wässerlecher Léisung ze spezifizéieren. Ob eng wässerlech Léisung als Säure oder als Basis reagéiert hänkt vun hirem Inhalt vu Waasserstoffionen (H+) of.
Wéi och ëmmer, och chemesch reng an neutralt Waasser enthält e puer Waasserstoffionen wéinst der Selbstdissoziatioun vum Waasser.
Et ass bekannt datt am Gläichgewiicht ënner Standardbedéngungen (750 mmHg a 25 °C), 1 L vu purem Waasser enthält Maul
y
Maul
Ionen, also, Waasser bei Standardtemperatur an Drock (STP) huet e pH vu 7.
Wat maache wann de pH vun eisem Pool NET geregelt ass

Wësst héich pH Pool Konsequenzen an d'Ursaachen vun engem héije pH an Ärem Pool

Wéi de pH vum Pool ze erhéijen a wat geschitt wann et niddereg ass

Wéi senken ech en héijen oder alkalesche Pool pH
Guiden wéi Dir Pool Ënnerhalt nieft dem pH mécht: Waasserreinigung an Desinfektioun

Nëtzlech Guide fir ze wëssen wéi ee Pool botzt

Guide fir e Pool mat Waasser an engem perfekte Zoustand z'erhalen
Sauer, neutral an alkalesch pH Wäerter
Klassifikatioun vun der Skala vun pH Wäerter
Wat sinn d'PH Wäerter

De pH-Skala geet vun 1 op 14, mam pH 7 ass eng neutral Léisung.
Also, et stellt sech eraus datt de pH e Wäert ass deen op enger logarithmescher Skala tëscht de Wäerter 0 (extrem sauer) an 14 (extrem alkalesch) ausgedréckt gëtt; Tëschenzäit fanne mir de Wäert 7 als neutral katalogiséiert.
pH Skala Universal pH Indikator
Wat heescht et datt eng Substanz e sauer oder alkalesche pH Niveau huet?
Wat sinn Säuren a Basen?
Säuren a Basen si Substanzen déi an der Natur existéieren a sech duerch hiren pH-Niveau ënnerscheeden, dat heescht duerch hiren Aciditéitsgrad oder Alkalinitéit. D'Bestëmmung, ob d'Substanzen sauer oder alkalesch sinn, gëtt vum Grad vun der Aciditéit oder der Alkalinitéit, déi duerch d'PH-Skala gemooss gëtt, regéiert a läit vun 0 (extrem sauer bis 14 (extrem alkalesch). Béid sinn awer meeschtens ätzend Substanzen, dacks gëfteg, déi trotzdem hunn vill industriell a mënschlech Uwendungen.
Wat sinn sauer Substanzen?
- Sauer pH Niveau: pH manner wéi 7
Wat heescht et datt de pH-Wäert sauer ass?
- Datt eng Substanz sauer ass heescht datt et reich an H ass+ (Waasserstoffionen): pH méi wéi 7
- Dofir, Säure si Substanzen mat engem pH manner wéi 7. (pH vum Waasser gläich wéi 7, als neutral ugesinn), deem seng Chimie allgemeng grouss Quantitéite vu Waasserstoffionen enthält wann Dir Waasser bäidréit. Si reagéieren normalerweis mat anere Substanzen andeems se Protonen verléieren (H+).
Wat sinn neutral Substanzen?
- Neutral pH Wäert: pH gläich wéi 7-
Wat heescht et datt de pH-Wert neutral ass?
- pH ass eng Moossnam fir wéi sauer / Basis d'Waasser ass.
- D'Gamme ass vun 0 bis 14, mat 7 neutral.
Wat sinn alkalesch Substanzen?
- Substanzen mat Basis oder alkalesche pH: pH méi wéi 7.
Wat heescht et wann de pH-Wäert alkalesch ass?
- Datt eng Substanz alkalesch ass heescht datt et aarm ass an H+ (oder reich an OH Basen-, déi den H+).
- Fir all dëst, Basen, op der anerer Säit, si Substanzen mat engem pH méi wéi 7., déi a wässerleche Léisungen normalerweis Hydroxylionen (OH-) an der Mëtt. Si tendéieren zu mächtegen Oxidanten, dat heescht, si reagéiere mat Protonen aus dem Ëmgéigend Medium.
Differenzen tëscht pH a pOH Wäerter

Wéi si se verwandt a wat sinn d'Ënnerscheeder tëscht ph a poh Miessunge?
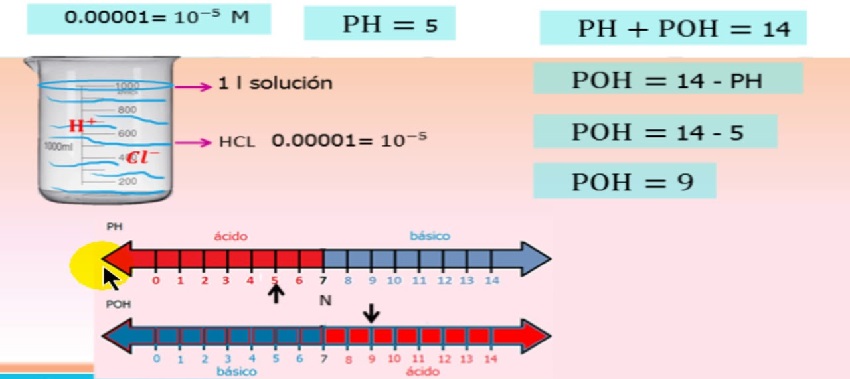
Natierlech hänkt d'Aktivitéit vun den Ionen vun der Ionkonzentratioun of an dëst gëtt an der Equatioun beschriwwen
pH / poH Ion Aktivitéit Equatioun
wou, - Waasserstoff Ion Aktivitéit
- Aktivitéitskoeffizient vum Waasserstoffion
- Waasserstoffion Konzentratioun
Den Aktivitéitskoeffizient ass eng Funktioun vun der Ionkonzentratioun a kënnt op 1 wéi d'Léisung ëmmer méi verdünnt gëtt.
Fir verdënntem (ideal) Léisungen ass de Standardzoustand vun der Léisung 1,00 M, sou datt seng Molaritéit seng Aktivitéit entsprécht.
Also, fir déi meescht Probleemer déi ideal Léisunge uhuelen, kënne mir de Logarithmus op d'Basis 10 vun der molarer Konzentratioun benotzen, net d'Aktivitéit.
Differenzen tëscht dem Wäert vum pH a pOH

Wat ass den normale pH-Wäert?
- Op eng Manéier ass de pH eng Moossnam déi benotzt fir den Niveau vun der Aciditéit oder der Alkalinitéit vun enger Léisung ze bestëmmen. De "p" steet fir "Potential", dofir gëtt de pH genannt: Potenzial vu Waasserstoff.
Wat ass de pOH Wäert?
- Fir Ären Deel. pOH ass eng Moossnam vun der Konzentratioun vun Hydroxylionen an enger Léisung. Et gëtt ausgedréckt als Basis 10 negativ Logarithmus vun der Hydroxylionkonzentratioun an, am Géigesaz zum pH, gëtt benotzt fir den Alkalinitéitsniveau vun enger Léisung ze moossen.

Wéi gëtt de pH oder pOH Wäert berechent?
Wat ass d'Formel fir ph Skala Wäerter?
- Wéi et scho bekannt ass, am wëssenschaftleche Beräich, de pH ass d'Mesure de d'Ionen bannen de eng Léisung. Dir musst vläicht Berechent pH baséiert op Konzentratioun. Berechent de pH Mat der Equatioun vun pH: pH = -log[H3O+].
Wat ass d'Formel fir pOH ze berechnen?
- Och den pOH (oder OH Potenzial) ass e Mooss fir d'Basisitéit oder Alkalinitéit vun enger Léisung. Also se benotzt den pH = - log [H3O+] fir d'Konzentratioun vun Hydroniumionen ze moossen [H3O+].

Schlëssel Equatioune fir de pH oder pOH Wäert ze berechnen
- pH=-log[H3O+]
- pOH=−log[OH−]
- [H3O+] = 10 dir- DéipH
- [Och- Déi] = 10 dir- DéipOH
- pH + pOH =pKw = 14.00 bei 25 °C.
Wat ass den Ënnerscheed tëscht der Skala vun de pH Wäerter an där vun pOH?
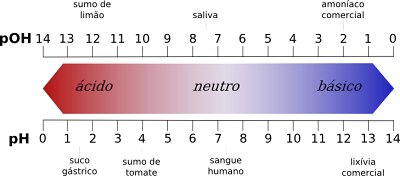
Ongläichheeten tëscht de Wäerter vun der pH Skala
- Engersäits gëtt d'PH Skala Säurewäerter vun 1 bis 6, während d'pOH Skala Säurewäerter vun 8 bis 14 gëtt.
- Ëmgekéiert gëtt d'PH Skala Basiswäerter vun 8 bis 14, während d'pOH Skala Basiswäerter vun 1 bis 6 gëtt.
Logarithmus Skala Relatioun vu ph a pOH mat hire Wäerter
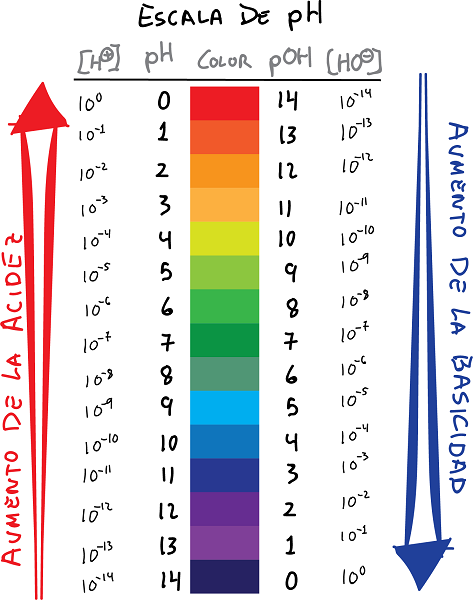
ph an pOH Skala Verbindung mat Faarwen a Wäerter
- pH ass de Logarithmus vun der Konzentratioun vun H Ionen+, mam Schëld geännert:
- Ähnlech definéieren pOH als Logarithmus vun der OH Ion Konzentratioun-, mam Zeechen geännert: Déi folgend Relatioun kann tëscht dem etabléiert ginn pH an der pOH.
- Prinzipiell ginn d'PH Wäerter den negativen Logarithmus vun der Waasserstoffionkonzentratioun, während de pOH Wäert den negativen Logarithmus vun der Hydroxidionkonzentratioun gëtt.
Ënnerscheed tëscht der Skala vu pH a pOH Wäerter
Ënnerscheeder tëscht dem ph Wäert Tabelle an pOH Wäert
Duerno gi mir Iech e Film wou Dir kënnt gesinn datt de pH d'Konzentratioune vu Waasserstoffionen moosst, während pOH d'Konzentratioune vun Hydroxylanionen oder Hydroxidionen moosst.


