
Indeksa naveroka rûpelê
En Ok Pool Reform, di vê beşê de di nav hewzên avjeniyê yên asta pH em ê derman bikin Cûdahiya di navbera ph û poh de di nirxên ava hewzê de.
PH di hewzê de çi ye û asta wê çawa be?

Wateya pH ya îdeal ji bo hewzên melevaniyê çi ye (7,2-7,4)
Akronîm pH ji bo hîdrojena potansiyel radiweste û pîvanek e ku asîdbûn an bingehînbûna avê destnîşan dike.
Ji ber vê yekê pH potansiyela hîdrojenê vedibêje, nirxek ku bi giraniya îyonên hîdrojenê di ava hewza we de têkildar e û ji ber vê yekê ew qasê ye ku asta asîtîbûn an bingehînbûna avê destnîşan dike. Ji ber vê yekê, pH berpirsiyar e ku hûrbûna îyonên H+ di avê de destnîşan bike, karaktera wê ya asîd an bingehîn diyar bike.
Pîvana nirxên pH yên ava hewzê


Pîvana pîvandina pH ya ava hewzê çi nirxan dihewîne?
- Pîvana pîvana pH nirxan ji 0 heta 14 digire.
- Bi taybetî 0 ya herî asîdî, 14 ya herî bingehîn e û pH-ya Neutral di 7 de cih digire.
- Ev pîvandin bi hejmara îyonên hîdrojena azad (H+) di maddeyê de tê diyarkirin.

Çima em pH hewce ne?
pH pîvanek e ku ji bo diyarkirina asîdbûn an bingehînbûna çareseriyek avî tê bikar anîn. Çareseriya avî wekî asîd an bazek bertek nîşan dide, bi naveroka wê ya îyonên hîdrojenê (H+) ve girêdayî ye.
Lêbelê, ava kîmyewî ya paqij û bêalî jî ji ber xwe veqetandina avê hin îyonên hîdrojenê dihewîne.
Tê zanîn ku di hevsengiya şert û mercên standard de (750 mmHg û 25°C), 1 lître ava paqij tê de heye. molek
y
molek
îyon, ji ber vê yekê, ava di germahî û zexta standard (STP) de pH 7 e.
Dema ku pH ya hewza me NE tertîb kirin emê çi bikin

Encamên pH-ya bilind û sedemên pH-ya bilind di hewza we de bizanibin

Meriv çawa pHya hewzê bilind dike û heke kêm be çi diqewime

Meriv çawa pHek hewzek bilind an alkalîn kêm dike
Rêbernameyên li ser meriv çawa ji bilî pH-ê lênihêrîna hewzê: paqijkirina avê û dezenfektekirinê

Rêbernameya kêrhatî ku hûn zanibin ka meriv hewzek çawa paqij dike

Rêbernameya ji bo domandina hewzek bi avê di rewşek bêkêmasî de
Nirxên pH yên asîdî, bêalî û alkaline
Dabeşkirina Pîvana Nirxên pH
Nirxên pH çi ne

Pîvana pH ji 1 heta 14 diçe, bi pH 7 çareseriyek bêalî ye.
Ji ber vê yekê, derdikeve holê ku pH nirxek e ku li ser pîvanek logarîtmîkî di navbera nirxên 0 (pir asîdî) û 14 (pir alkaline) de tê diyar kirin; Di navberê de em nirxa 7 wekî bêalî katalogkirî dibînin.
Pîvana pH nîşana pH ya gerdûnî
Wateya wê çi ye ku maddeyek xwedan asta pH a asîdî an alkalîn e?
Asîd û baz çi ne?
Asît û baz ew maddeyên ku di xwezayê de hene û ji hêla pH-ya xwe ve, ango ji hêla astîbûn an alkalîniya xwe ve têne cûda kirin. Tesbîtkirina asîdî an alkalînbûna maddeyên ji hêla astîbûn an alkalînîteyê ve bi pîvana pH-ê ve tê pîvandin û ji 0 (pir asîdî heya 14 (pir alkaline) diguhere. Lêbelê her du jî bi gelemperî maddeyên gemarî ne, pir caran jehrîn in. dîsa jî gelek sepanên pîşesazî û mirovî hene.
Madeyên asîdî çi ne?
- Asta pH a asîdê: pH ji 7 kêmtir
Wateya wê çi ye ku nirxa pH asîdî ye?
- Ku maddeyek asîdî ye, tê vê wateyê ku ew bi H-yê dewlemend e+ (îyonên hîdrojen): pH ji 7 mezintir
- Ji ber vê yekê, Asîd madeyên ku pH wan ji 7 kêmtir e. (pH ya avê bi 7 re, bêalî tê hesibandin), ku kîmya wê bi gelemperî mîqdarên mezin îyonên hîdrojenê dihewîne dema ku avê lê zêde bike. Ew bi gelemperî bi maddeyên din re bi windakirina protonan re reaksiyonê dikin (H+).
Madeyên bêalî çi ne?
- Nirxa pH ya bêalî: pH wekhev 7-
Wateya wê çi ye ku nirxa pH bêalî ye?
- pH pîvanek e ku av çiqas asîdî/bingehîn e.
- Rêjeya ji 0 heta 14 e, ku 7 bêalî ye.
Madeyên alkaline çi ne?
- Madeyên bi pH-ya bingehîn an alkalîn: pH ji 7 mezintir.
Wateya wê çi ye dema ku nirxa pH alkalîn e?
- Ku maddeyek alkalîn e, tê vê wateyê ku ew di H de xizan e+ (an jî di bingehên OH de dewlemend in-, ku H+).
- Ji bo van hemî, Ji aliyê din ve, baz madeyên ku pH ji 7 mezintir in., ku di çareseriyên avî de bi gelemperî îyonên hîdroksîl (OH-) di navberê de. Ew mêl dikin ku bibin oksîdantên hêzdar, ango, ew bi protonên ji navgîniya derdorê re reaksiyon dikin.
Cûdahiya di navbera nirxên pH û pOH de

Ew çawa têkildar in û cûdahiyên di navbera pîvandinên ph û poh de çi ne?
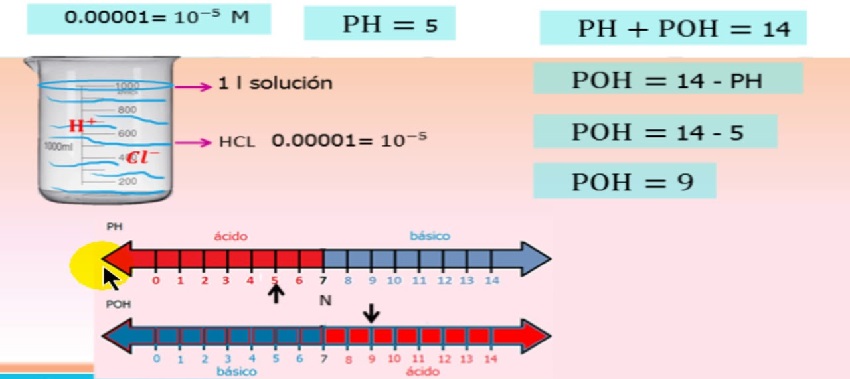
Bê guman, çalakiya îyonan bi kombûna îyonan ve girêdayî ye û ev di hevkêşeyê de tê vegotin
Wekheviya çalakiya pH/poH ion
ko, - çalakiya hîdrojen ion
- rêjeya çalakiya îona hîdrojenê
- kombûna îyona hîdrojenê
Rêjeya çalakiyê fonksiyonek ji kombûna ionê ye û ji ber ku çareserî her ku diçe hûrtir dibe nêzî 1 dibe.
Ji bo çareseriyên dilteng (îdeal), rewşa standard ya solê 1,00 M e, ji ber vê yekê molarîta wê bi çalakiya wê re ye.
Ji ber vê yekê, ji bo piraniya pirsgirêkên ku çareseriyên îdeal digirin, em dikarin logarîtmê li gorî bingeha 10-ê ya hûrbûna molarê bikar bînin, ne çalakiyê.
Cûdahî di navbera nirxa pH û pOH de çi ye

Nirxa pH ya normal çi ye?
- Bi awayek, pH pîvanek e ku ji bo destnîşankirina asta asîdbûn an alkalînîteya çareseriyê tê bikar anîn. "p" tê wateya "potansiyel", ji ber vê yekê pH tê gotin: potansiyela hîdrojenê.
Nirxa pOH çi ye?
- Ji bo we. pOH pîvana hûrbûna îyonên hîdroksîl di nav çareyekê de ye. Ew wekî logarîtma negatîf a bingehê 10 ya giraniya îyona hîdroksîl tê destnîşan kirin û, berevajî pH, ji bo pîvandina asta alkalînîteya çareseriyê tê bikar anîn.

Nirxa pH an pOH çawa tê hesibandin?
Formula ji bo nirxên pîvana ph çi ye?
- Wekî ku tê zanîn, di warê zanistî de, pH pîvan e de îyonên hundir de çareseriyek. Dibe ku hûn neçar bibin pH hesab bike li ser bingeha konsantre. Hesab bike pH Bikaranîna hevkêşeya pH: pH = -log[H3O+].
Formula hesabkirina pOH çi ye?
- Her weha, pOH (an potansiyela OH) pîvana bingehîn an alkalîniya çareseriyê ye. Jî se pH = - log [H3O+] ji bo pîvandina hûrbûna îyonên hîdronyumê [H3O+].

Wekheviyên sereke ji bo hesabkirina nirxa pH an pOH
- pH=−log[H3O+]
- pOH=−log[OH−]
- [H3O+] = 10- JipH
- [oh- Ji] = 10- JipOH
- pH + pOH =pKw = 14.00 li 25 °C.
Cûdahiya di navbera pîvana nirxên pH û ya pOH de çi ye?
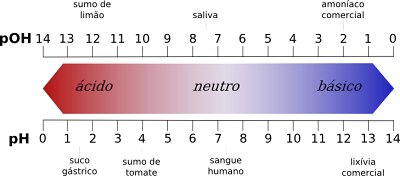
Newekheviyên di navbera nirxên pîvana pH de
- Ji aliyek ve, pîvana pH nirxên asîdê ji 1 heta 6 dide dema ku pîvana pOH nirxên asîdê ji 8 heta 14 dide.
- Berevajî vê, pîvana pH nirxên bingehîn ji 8 heta 14 dide, dema ku pîvana pOH nirxên bingehîn ji 1 heta 6 dide.
Têkiliya pîvana logarîtmê ya ph û pOH bi nirxên wan re
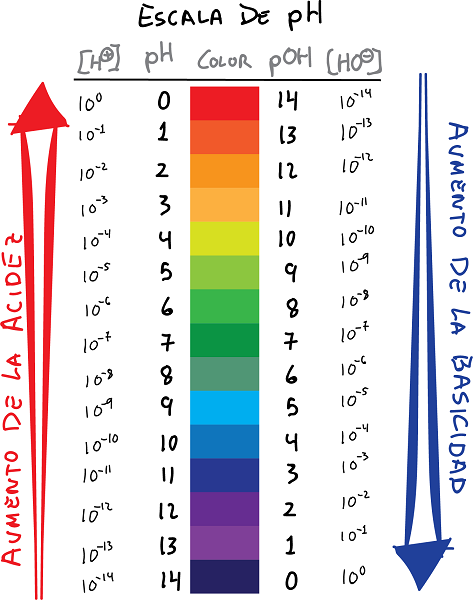
Têkiliya pîvana ph û pOH bi reng û nirxan re
- pH logarîtma kombûna îyonên H ye+, bi nîşana guherî:
- Bi heman awayî, diyar bike pOH wek logarîtma konsantrasyona OH ion-, bi nîşana guherî: Têkiliya jêrîn dikare di navbera pH û pOH.
- Di bingeh de, nirxên pH-ê logarîtmaya neyînî ya giraniya îyona hîdrojenê dide, dema ku nirxa pOH logarîtma neyînî ya giraniya ion hîdroksîd dide.
Cûdahiya di navbera pîvana nirxên pH û pOH de
Nakokiyên di navbera tabloya nirxa ph û nirxa pOH de
Piştî wê, em fîlimek pêşkêşî we dikin ku hûn dikarin bibînin ku pH hûrgelên îyonên hîdrojenê dipîve, dema ku pOH hûrbûna anyonên hîdroksîl an îyonên hîdroksîd dipîve.


