
Innéacs ábhar an leathanaigh
En Ceart go leor Athchóiriú Snámha laistigh de Treoir cothabhála uisce linn snámha Ba mhaith linn tú a chur in aithne don alt seo a leanas: Conas alcaileacht uisce linne a thomhas.
alcaileacht linn snámha cad é

Linn Alcaileachta: paraiméadar bunúsach maidir le díghalrú uisce na linne
Ar an gcéad dul síos, cuir béim ar sin Ceann de na bunpharaiméadair atá le rialú nuair a dhéanaimid cothabháil ná an alcaileacht mar aon le pH na linne.
Conas a dhéantar cóireáil cheart ar cheimic an uisce linne
Is tomhas é alcaileacht ar airíonna maoláin uisce.
Déantar é a thomhas i milleagraim de charbónáit chailciam in aghaidh an lítir (mg/L) agus de ghnáth bíonn sé i raon 80-120 mg/L.
Tá tionchar cinnte ag alcaileacht ar pH toisc go bhfeidhmíonn sé mar thaiscumar d'ian hidrigine ar féidir leo aigéid a neodrú agus is lú an seans go n-athródh pH.
Mar sin, cinntíonn luach alcaileachta 80-120 mg/L go mbeidh an pH beagán cobhsaí fiú má athraíonn an cheimic uisce.
Ina theannta sin, tá ról ag alcaileacht i gcreimeadh miotail, ag gníomhú mar bhac taise a chosnaíonn dromchlaí miotail ó dhamáiste.
Mar sin, tá luach leordhóthanach alcaileachta tábhachtach d'úsáideoirí uisce cónaithe agus tráchtála araon.
Cad é alcaileacht linn snámha
Chun tús a chur leis, mínigh go bhfuil an alcaileacht Is é cumas an uisce aigéid a neodrú, tomhas ar na substaintí alcaileacha go léir a thuaslagtar san uisce (carbónáití, décharbónáití agus hiodrocsaídí), cé go bhféadfadh bóráití, sileacáití, níotráití agus fosfáití a bheith i láthair freisin.
Feidhmíonn alcaileacht mar éifeacht na n-athruithe pH a rialáil.
Mar sin, mura bhfuil tú i gceannas ar na luachanna cuí, ní bheidh tú in ann uisce a bheith agat i do linn atá díghalraithe go maith agus trédhearcach.
Leibhéal alcaileachta linn snámha molta
alcaileacht linn snámha molta é idir 125-150 ppm.
Meabhrúchán: i gcásanna áirithe, d'fhéadfadh pH ceart a bheith ag an uisce, ach ina ionad sin féadfaidh an alcaileacht a bheith íseal nó ard.
Conas a nasctar pH uisce na linne agus alcaileacht

Cad é pH na linne?
Méadú nádúrtha ar pH: cailliúint dé-ocsaíd charbóin
Sainmhínítear pH tuaslagáin mar logartamach diúltach luach mheántiúchan na n-ian hidrigine.
- Ós rud é gur féidir le hiain H dí-chomhcheangal le H2O agus H2CO3, is féidir an pH a athrú ar dhá bhealach: H2O a shuimiú nó a bhaint nó H2CO3 a shuimiú nó a bhaint. Nuair a chailltear dé-ocsaíd charbóin as linn trí ghalú, méadaíonn an pH.
- Tá sé seo amhlaidh toisc go bhfuil aigéadacht i bhfad níos airde ag H2CO3 ná mar atá ag H2O; I dtéarmaí coibhéise aigéad, is é 2 an Kw de H3CO3400 i gcomparáid leis an Kw de H2O de 25.
- I dtéarmaí dhlí Henry, is é 2 an K a le haghaidh CO3,18. De réir mar a mhéadaíonn an pH, méadaíonn tiúchan na n-ian H, agus déanfaidh na prótóin iomarcacha "ianaithe" i H2O agus H2CO3 ar deireadh thiar.
Mar sin, i linn aigéadach, tá an ráta athraithe ar pH teoranta ar deireadh thiar ag an ráta imoibrithe idir H2CO3 agus H2O.
- ; braitheann an luas seo ar an teocht, chomh maith le láithreacht coscairí cosúil le sulfáit chailciam nó décharbónáit.
- Dá bhrí sin, tá sé tábhachtach pH a rialú i gcomhar leis an gcuid eile den cheimic linn snámha, seachas modhanna rialaithe pH traidisiúnta a úsáid le spriocluachanna seasta.

Taispeánann an léaráid seo conas a bhaintear dé-ocsaíd charbóin (CO2) as uisce nuair a aeraítear é.
- Nuair a bhíonn an t-uisce aeraithe, tosaíonn an dé-ocsaíd charbóin a thuaslagadh san uisce a thuaslagadh go nádúrtha san uisce.
- Ardaíonn an iomarca dé-ocsaíd charbóin go barr na linne, áit ar féidir é a ghabháil agus a scaoileadh isteach san atmaisféar.
Dá fuaire an linn snámha, is amhlaidh is tapúla a thiocfaidh an CO2 amach as an uisce go nádúrtha.
- In aeráidí te grianmhara le go leor galú, b'fhéidir go mbeadh sé riachtanach an t-uisce a aeráil arís agus arís eile sa lá chun leibhéil dé-ocsaíd charbóin a choinneáil laistigh den raon atá ag teastáil.
Léaráid den phróiseas cothromaíochta CO2,

Is gnách go lorgaíonn CO2 cothromaíocht idir dromchla an uisce agus an t-aer comhthimpeallach.
Mar sin, scaoiltear CO2 go dtí go bhfuil sé i gcothromaíocht choibhneasta leis an aer os cionn na linne. Tugtar dlí Henry ar an bhfeiniméan seo.
Is gnách go lorgaíonn CO2 cothromaíocht idir dromchla an uisce agus an t-aer comhthimpeallach.
Mar sin, scaoiltear CO2 go dtí go bhfuil sé i gcothromaíocht choibhneasta leis an aer os cionn na linne. Tugtar dlí Henry ar an bhfeiniméan seo.
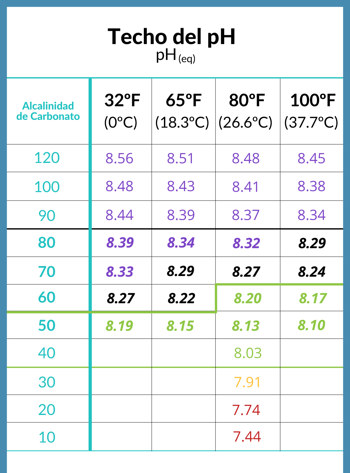
Ceangal idir an uasteorainn an leibhéal pH an uisce linn snámha agus alcaileacht
Uisce linn snámha ard pH agus comhghaol le alcaileacht
- I gcórais uisceacha, tá tionchar mór ag pH ar cheimic uisce.
- Rialaíonn pH tiúchan na n-ian éagsúla, agus is féidir le hathruithe ar pH tionchar a imirt ar chineálacha agus ar líon na speiceas atá i láthair.
- Mar shampla, tá pH 7 iontach chun feidhm éiceachórais a chothabháil, ach d’fhéadfadh pH de 8 a bheith ró-íseal do roinnt orgánaigh agus ró-ard do speicis eile.
Nuair a shroicheann an CO2 san uisce cothromaíocht leis an aer os cionn an dromchla uisce, deirtear go bhfuil an pH tar éis a uasteorainn a bhaint amach, agus déantar an uasteorainn sin a chinneadh ag leibhéal alcaileacht carbónáit san uisce.
- Is é alcaileacht carbónáit an uisce a chinneann an uasteorainn pH, nó an luach pH atá oiriúnach don uisce ina iomláine.
- Is féidir na huasteorainneacha éagsúla faoi imthosca éagsúla a fheiceáil sa tábla seo a leanas a chuir an poitigéir Richard Falk ar fáil.
Cén difríocht atá idir alcaileacht na linne agus pH an uisce?
Difríocht idir Alcaileacht Linnte agus Leibhéal pH an Uisce
Ar smaoinigh tú riamh cad é an difríocht idir pH agus alcaileacht?
Nuair a mheastar go bhfuil an leibhéal alcaileachta ard
Ar thaobh amháin, nuair a bhíonn an tiúchan carbónáit chailciam os cionn 175 csm, labhraímid faoi alcaileacht ard.
Bíonn tionchar ag alcaileacht ard
Ansin, luaimid roinnt de na affectations a tháirgtear nuair a bhíonn an alcaileacht ard.
- Méadú suntasach ar pH.
- Uisce neamh-trédhearcach, cosúil le scamallach.
- Greannú na súl, na gcluasa, na srón agus na scornach.
- Foirmiú scála ar na ballaí agus gabhálais.
- Luasghéarú ar chaitheamh na n-ábhar linn snámha.
- Cailliúint éifeachtacht an dífhabhtán linn snámha.
Cad is cúis le alcaileacht ard?
Is féidir go dtiocfaidh méadú ar alcaileacht ar fhachtóirí éagsúla. Seasann siad amach uathu:
- Is féidir le galú uisce mar gheall ar athruithe ar an méid uisce mar gheall ar ghníomhaíocht na gréine agus na gaoithe a bheith ina chúis le méadú ar alcaileacht.
- Is gnách go dtiocfaidh méadú ar alcaileacht trí úsáid a bhaint as an linn snámha, mar gheall ar éifeacht uachtair gréine, allais agus dramhaíola...
- Uaireanta nuair a líonaimid an t-uisce, má bhí sé i dteagmháil le carraigeacha carbónáit d'fhéadfadh go mbeadh linn snámha ard alcaileachta ann.
- Mí-úsáid ceimiceán.
- Mífheidhmeanna sa chóras scagtha linn snámha.
Conas alcaileacht linn snámha a ísliú
Conas Alcaileacht Linn Snámha a Laghdú
- Ar dtús, ní mór dúinn an caidéal linn snámha a mhúchadh agus fanacht thart ar uair an chloig.
- Ansin, ní mór an méid laghdaitheora pH is gá a chur leis (de réir áise) agus é a dháileadh chun dé-ocsaíd charbóin décharbónáite a dhéanamh air. TABHAIR FAOI DEARA: Chun 10 ppm d'alcaileacht na linne a laghdú, is gá thart ar 30 ml a dháileadh ar gach méadar ciúbach d'uisce na linne (i bhformáid leachtach nó soladach).
- Ansin, tar éis uair an chloig, casaimid an caidéal ar ais.
- Tar éis thart ar 24 uair an chloig, déanfaimid na leibhéil alcaileachta a thomhas arís.
- Ar an láimh eile, má thugaimid faoi deara nach bhfuil leibhéil alcaileacht an uisce linne tite i 2 nó 3 lá, déanfaimid an próiseas arís (uaireanta is féidir gur próiseas costasach é).
- Ina theannta sin, ní mór dúinn i gcónaí na leibhéil pH a athbhreithniú, mar is féidir leo seo titim.
[bosca amazon= «B00PQLLPD4 » button_text=»Ceannaigh» ]
Nuair a mheastar go bhfuil an leibhéal alcaileachta íseal
Sa chás seo, nuair a bhíonn an tiúchan carbónáit chailciam níos ísle ná 125 csm, labhraímid faoi alcaileacht íseal.
Iarmhairtí Íseal Alcaileacht
I measc na n-éifeachtaí a tháirgeann an titim san alcaileacht san uisce is féidir linn a fháil:
- Go ginearálta, beidh pH ár linne íseal. Ina theannta sin, beidh sé deacair é a rialú agus a chobhsú.
- Mar gheall ar na himthosca seo, déanfaimid go leor dífhabhtán a ithe ós rud é nach bhfuil an éifeachtacht chéanna aige.
- Ró-fheidhmiú na gcóras scagtha.
- Beidh cuma glas ar an uisce inár linn snámha.
- Cruthaíonn sé creimeadh agus stains ar chodanna miotail agus gabhálais na linne.
- Chomh maith leis sin, cuireann sé greannú ar na súile, srón, scornach agus craiceann.
- Ar deireadh, má chomhcheanglaíonn tú alcaileacht íseal le pH íseal, foirmeoidh algaí san uisce, rud a fhágann go mbeidh cuma glas air.
Cad is cúis le alcaileacht íseal?
D’fhéadfadh titim gan choinne ar an leibhéal alcaileachta san uisce linn a bheith mar gheall ar na fachtóirí seo a leanas:
- Táirgí míchuí nuair a bhíonn tú ag déanamh cothabhála linn snámha (seachas táibléad le feidhmeanna iolracha a úsáid, éiríonn an t-uisce aigéadach).
- Fachtóir amháin a d’fhéadfadh a bheith ann nach bhfuil trealamh scagacháin na linne ag obair i gceart.
- Má tá athruithe aeráide láidir i dteocht.
alcaileacht linn snámha a ardú
Conas alcaileacht linn snámha a ardú

Conas Alcaileacht Linn a Mhéadú
alcaileacht a ardú
alcaileacht na linne a mhéadú: is é seo an cás is coitianta
Is é seo an cás is coitianta, ós rud é go mbíonn alcaileacht an uisce sconna an-íseal de ghnáth (i roinnt réimsí sa Spáinn tá sé chomh híseal le 10 nó 20 csm). Agus freisin toisc gurb é an ceartú is coitianta ar an rialtóir pH ná an pH a ísliú, atá ag ardú le clóirín, agus an pH a ísliú, caitheann muid aigéad, rud a íslíonn an alcaileacht freisin (cé go pointe i bhfad níos lú ná an pH) .
Is féidir le méadú ar alcaileacht uisce do linne a bheith ar cheann de na chéad chéimeanna chun cothromaíocht a fháil ar ais.
- Nuair a bhíonn pH íseal ag d'uisce, is féidir leis cur isteach ar pH do linne agus cruthaíonn sé roinnt fadhbanna, lena n-áirítear uisce scamallach agus easpa soiléireachta. Chun cabhrú le alcaileacht d'uisce a mhéadú, is féidir leat púdar sóid bácála nó criostail sóid bácála a úsáid. Bí cinnte nach n-úsáideann ach an méid atá molta do do linn nó do Spa, mar is féidir leis an iomarca tionchar diúltach a bheith aige ar pH an uisce. Nuair a fheiceann tú feabhas ar shoiléireacht do chuid uisce, beidh ort monatóireacht leanúnach a dhéanamh ar do leibhéil alcaileachta chun a chinntiú go bhfanfaidh siad san áit ar gá dóibh a bheith.
ardú linn snámha décharbónáite alcaileacht
Chun an alcaileacht a ardú is fearr sóid bácála a úsáid.
Is féidir le méadú ar alcaileacht uisce do linne a bheith ar cheann de na chéad chéimeanna chun cothromaíocht a fháil ar ais. Nuair a bhíonn pH íseal ag d'uisce, is féidir leis cur isteach ar pH do linne agus cruthaíonn sé roinnt fadhbanna, lena n-áirítear uisce scamallach agus easpa soiléireachta. Chun cabhrú le alcaileacht d'uisce a mhéadú, is féidir leat púdar sóid bácála nó criostail sóid bácála a úsáid. Bí cinnte nach n-úsáideann ach an méid atá molta do do linn nó do Spa, mar is féidir leis an iomarca tionchar diúltach a bheith aige ar pH an uisce. Nuair a fheiceann tú feabhas ar shoiléireacht do chuid uisce, beidh ort monatóireacht leanúnach a dhéanamh ar do leibhéil alcaileachta chun a chinntiú go bhfanfaidh siad san áit ar gá dóibh a bheith.
Is púdar bán é décharbónáit sóidiam, éasca a thuaslagadh in uisce agus a láimhseáil, níl sé go háirithe tocsaineach agus ní dhéanann sé damáiste don chraiceann má dteagmháil léi, agus mar sin beidh sé éasca é a dháileog agus é a dhoirteadh isteach sa linn. Ina theannta sin, ní chuireann décharbónáit sóidiam le dul in aois nó le tocsaineacht an uisce (in alt eile labhróimid faoi cad is brí le seanuisce...).
Is féidir fuinseog sóid a úsáid freisin
, agus sóid loiscneach, ach ní mholaimid é, ós rud é go gcuireann siad isteach i bhfad níos mó ar an pH, agus is é an rud atá i gceist ná iarracht a dhéanamh an alcaileacht a ardú leis an éifeacht is lú is féidir ar an pH (ionas go mbeidh an próiseas iomlán níos éasca).
Chun smaoineamh a thabhairt duit, chun 10 ppm d'alcaileacht a mhéadú, is é an éifeacht ar an pH ag brath ar an tsubstaint a úsáidtear:
Décharbónáit sóidiam: mhéadódh an pH 0,017
Carbónáit sóidiam: mhéadódh an pH 0,32
Sóid loiscneach: mhéadódh an pH 0,6
Is sampla é seo den éifeacht mhéadaithe pH is féidir a bheith ag alcaileacht ar aigéadacht an uisce. Chun smaoineamh a thabhairt duit, chun 10 ppm d'alcaileacht a mhéadú, is é an éifeacht ar an pH ag brath ar an tsubstaint a úsáidtear:
Décharbónáit sóidiam: mhéadódh an pH 0,017
Carbónáit sóidiam: mhéadódh an pH 0,32
Sóid loiscneach: mhéadódh an pH 0,6
Is sampla é seo den éifeacht mhéadaithe pH is féidir a bheith ag alcaileacht ar aigéadacht an uisce. Chun smaoineamh a thabhairt duit, chun 10 ppm d'alcaileacht a mhéadú, is é an éifeacht ar an pH ag brath ar an tsubstaint a úsáidtear:
Cé mhéad sóid bácála a theastaíonn uaim?
Is é an riail ordóg ná go dteastaíonn 17,3 gram de shóid aráin uait chun an alcaileacht a ardú 10ppm in aghaidh gach m3 de do linn.
Nó cad é mar an gcéanna:
Méid i ngraim = (Alcaileacht Inmhianta – Alcaileacht Iarbhír) x (comhthiomsú m3) x 1,73
TABHAIR FAOI DEARA: Cuimhnigh gur meastacháin iad na ríomhanna seo agus go bhféadfadh siad a bheith éagsúil ó linn go chéile.
Tabhair sampla do linn snámha 50 m3, agus is é 30 ppm an leibhéal alcaileachta reatha. Sa chás seo beidh muid ag iarraidh 100 ppm a bhaint amach, mar sin ní mór dúinn:
(100 – 30) x 50 m3 x 1,73 = 6055 gram de shóid aráin (6 kg, le slánú).
Conas ba cheart dom é a bhainistiú?
Is é an idéalach dul beagán ar bheagán. Tá foirmlí teoiriciúla ann don uasmhéid ceimiceán ba chóir duit a chur sa linn gach lá. Sa domhan idéalach seo, bheadh an t-uasmhéid décharbónáite i linn 50 m3 360 gram in aghaidh an lae. Ach tá a fhios againn go bhfuil go leor uaireanta nach bhfuil sé indéanta, toisc nach bhfuil aon am. Leis an uisce atá againn i go leor áiteanna, thógfadh sé beagnach mí chun an alcaileacht a cheartú. Nó i gcás algaí a bhaint, ní féidir linn a ghlacadh chomh fada sin.
Dá bhrí sin, déan iarracht dul beagán ar bheagán, toisc go bhfuil an t-am agat, ós rud é go dtuigeann ceimic an uisce go bhfuil na hathruithe chomh de réir a chéile agus is féidir.
Chun décharbónáit a riar, caolaigh in uisce, cas ar an scagachán, agus a dháileadh ar fud an linn snámha, mar atá le beagnach gach ceimiceán. Agus fág an scagachán ar feadh thart ar 4-6 uair an chloig.
Moltar an rialtóir pH a dhíghníomhachtú agus an próiseas seo á dhéanamh. Trí dhécharbónáit sóidiam a riar, ardóidh an pH, ach beidh sé momentary, ansin déanfaidh sé cobhsú.
Níl pH luaite againn sa phróiseas iomlán seo. Agus is é sin nuair is gá an alcaileacht a mhéadú, díreoimid ar a leibhéal idéalach a bhunú, agus ansin déanfaimid an pH eile a thomhas agus a choigeartú.
Má bhí an pH ard roimh an alcaileacht a ardú, ní ardóidh an décharbónáit sóidiam go mór é, ní mór an pH ard seo a cheartú tar éis an alcaileacht.
Agus má bhí an pH íseal, rachaidh sé suas beagán mar a théann an alcaileacht suas, ach is fearr fanacht go dtí go mbeidh an alcaileacht agat ag leibhéal oiriúnach sula ndéantar é a choigeartú. Cuimhnigh freisin, le alcaileacht íseal, nach bhfuil an pH cosanta, agus is féidir leibhéil ard nó íseal de a bheith mar gheall ar an easpa cosanta seo. Sin é an fáth go gcaithfidh tú fanacht go dtí go mbeidh alcaileacht idir 80 agus 100 agat agus ansin an pH a thomhas agus a choigeartú.
alcaileacht a laghdú
Ní gnách go mbeadh ort an alcaileacht a laghdú. Toisc go mbíonn leibhéal íseal ag an soláthar uisce de ghnáth, agus toisc go mbíonn ar an rialtóir pH an pH a laghdú de ghnáth (agus nuair a bhíonn aigéad á dáileog tá laghdú ar alcaileacht freisin).
Ach tá cásanna ann, mar atá i roinnt screamhuisce, nuair a thagann an soláthar le pH ardaithe agus alcaileacht. Nó tarlaíonn sé freisin gur cuireadh ceimiceáin go neamh-idirdhealaitheach leis an uisce, rud a tháirgeann míchothromaíochtaí láidre, agus ard-alcaileacht ar cheann acu.
Chun alcaileacht a laghdú bíonn an modh difriúil má tá an pH ard nó íseal:
Laghdaigh alcaileacht le pH ard
Ná déan iarracht an pH a ísliú mar beidh sé an-deacair. Tá cumhacht ard ag alcaileacht ard chun aigéid a neodrú (is é an sainmhíniú ar alcaileacht), agus is beag éifeacht a bheidh ag aon aigéad a instealladh againn ar an pH.
Agus sna cásanna seo, is éard atá sa teicníc eitseáil a instealladh (ar a dtugtar freisin aigéad hidreaclórach nó salfumán nó aigéad muriatach) chomh fada agus is féidir ag bun an linne (le feadán, mar shampla). Ní mór dúinn aigéad hidreaclórach a úsáid chomh tiubh agus is féidir, tá súil againn 30%.
Nuair a dhéanaimid an t-aigéad a instealladh, ní mór dúinn an gléasra cóireála séarachais a mhúchadh, agus ní théann sé ar siúl go dtí an lá dár gcionn.
Is é an méid aigéad hidreaclórach i cc agus ag 30% a theastaíonn uainn:
1,55 x (m3 den linn) x (léamh alcaileachta reatha – an leibhéal alcaileachta inmhianaithe)
Leis an sampla atá againn den linn 50 m3, agus ag glacadh leis go dtosaímid ó alcaileacht 180 ppm, chun alcaileacht 100 ppm a bhaint amach ní mór dúinn:
1,55 x 50 x (180 – 100) = 6200 cc = 6,2 lítear 30% eitseála
Níor cheart dúinn iarracht a dhéanamh níos mó ná 40-50 csm d'alcaileacht a ísliú gach lá. Más gá, déan é a roinnt ina sheisiúin éagsúla.
Ag 24 uair an chloig tomhaisimid an leibhéal alcaileachta agus pH, agus is féidir linn teacht ar 3 chás:
- Alcaileacht idir 80 agus 120, agus pH i raon chomh maith (thart ar níos lú ná 7,5 do linnte le clóirín, agus 7,8 do linnte le bróimín): sa chás seo tá muid ceart go leor, táimid déanta, bhí sé éasca.
- Alcaileacht fós os cionn 120, agus pH níos airde ná nó cothrom le 7,2. Is féidir linn an nós imeachta a bhaineann le heitseáil a instealladh arís, ach an sprioc a leagan síos dúinn féin an alcaileacht a ísliú ó 10 go 10 csm. Tá sé seo amhlaidh toisc go bhfuil an pH beagnach ag an teorainn, agus má théann muid i bhfad ró-titfidh sé go dtí leibhéal as a ní bheidh muid in ann é a ardú níos déanaí.
Go deimhin, má thiteann an pH faoi 7,0 in aon cheann de na seisiúin níor cheart dúinn leanúint ar aghaidh, agus beidh orainn an modh a thuairiscítear thíos a chur i bhfeidhm chun alcaileacht le pH íseal a laghdú. - Alcaileacht fós ard, ach pH faoi bhun 7,0 – 7,2: ní mór dúinn gan leanúint ar aghaidh, ní mór dúinn a chur i bhfeidhm ar an teicníc a laghdú alcaileacht le pH íseal.
Laghdaigh alcaileacht le pH íseal
Nuair a bhíonn an pH íseal agus an alcaileacht ard, is é an cás is measa, ós rud é gurb é an tráth is deacra an t-iarmhéid a ghnóthú. Má dhéanaimid aigéad a chur i bhfeidhm, beidh an pH ag titim níos mó, agus ansin beidh orainn bunanna a sholáthar chun é a chothromú, ach déanfaidh siad an alcaileacht a ardú arís, agus cuirimid isteach lúb. Cuimhnigh go ndéantar pH agus alcaileacht beagnach i gcónaí a mhodhnú sa treo céanna, agus dá bhrí sin níl sé soiléir iad a thiomáint sa treo eile.
Toisc nach féidir linn an pH a ardú le harduithe pH (toisc go n-ardóidh an alcaileacht níos mó), ansin ní mór dúinn modh ar a dtugtar aeraithe a úsáid, trína gcuirtear an t-uisce faoi réir nós imeachta fisiceach "aer a instealladh" ionas go gcaillfidh sé a gháis tuaslagtha, go háirithe dé-ocsaíd charbóin (CO2 ). Gan dul isteach i mórán anailíse ceimiceach, abair gur trí CO a thuaslagadh2 san uisce laghdaítear a pH, agus má éiríonn linn é a dhealú ón uisce, méadóimid é.
Tá sé léite agat i gceart, tríd an tobar uisce a aeráil éiríonn linn CO a bhaint2 agus is próiseas fisiceach é a pH a ardú, gan aon cheimiceáin a chur leis.
Tá go leor bealaí ann chun an t-uisce a aeráil, is cuma cad is féidir leat smaoineamh air. Is féidir leat na thrusters a threorú chun vortex beag a ghiniúint, ach is beag an éifeacht. D’fhéadfá splanc timpeall ar feadh na hoíche…. Ach is é an rud is úsáidí ná go ndéanann tú "fountain" beag: le píopa PVC agus cúpla uillinn déanann tú sioráf de chineál; Ceanglaíonn tú foirceann amháin le impeller, agus ar an taobh eile cuireann tú breiseán PVC ina ndéanann tú poill bheaga, amhail is dá mba cheann cithfholcadh é. Is féidir leis an uillinn níos ísle a bheith 45 céim ionas go mbeidh siad "plug" an t-uisce níos díreach isteach sa linn.
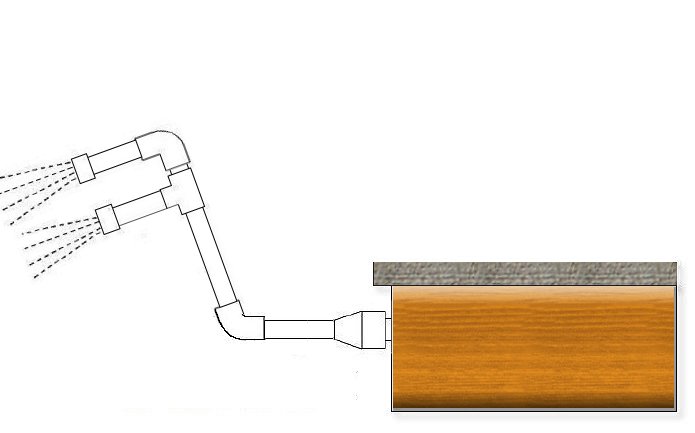
Casann tú ar an scagachán, agus más féidir leat a chlúdach an impellers eile ionas go mbeidh an brú níos airde, is amhlaidh is fearr. Tá gá le huaireanta oibriúcháin, braitheann sé ar mhéid na linne agus ar an leibhéal pH, ach beidh ort é a rith nach lú ná 6-8 uair an chloig. Agus feicfidh tú go mbeidh an pH tar éis ardú beagán.
Tá uillinn agus píopa éasca a fháil, b'fhéidir níos deacra conas é a cheangal leis an impeller. Más iad do impellers linn na cinn ABS bán tipiciúil le caipín scriú, is féidir leat píopa PVC 32mm a cheangal leis an gcuid seo a leanas:

Nuair a éiríonn linn an pH a ardú go 7,2, déanaimid an t-aigéad hidreaclórach a ath-instealladh chun an alcaileacht a ísliú. Dá airde atá an pH ardaithe againn, is amhlaidh is fearr, mar is féidir linn méid níos mó alcaileachta a cheartú. Más féidir linn é a ardú go 7,6, is amhlaidh is fearr. Cuimhnigh nach gá duit ceartú alcaileachta a dhéanamh a laghdódh an pH faoi bhun 7,0 – 7,2
NÓTA TÁBHACHTACH: Sea, mar a fuair tú amach díreach, easanna, easanna, etc. sna linnte nach bhfuil siad «neamhchiontach“…. tionchar díreach a bheith acu ar ardú pH, mar sin féadfar a úsáid (nó mí-úsáid) a contraindicated ag brath ar na coinníollacha ...
Ceannaigh Méadaitheoir alcaileacht Snámha
Praghas méadaitheora alcaileacht linne
[bosca amazon = «B071458D86, B07CLBJZ8J , B071458D86, B08TC3DZZD» button_text=»Ceannaigh» ]
Méadar alcaileacht uisce linne

Beart chun alcaileacht a thomhas: stiallacha anailíseacha.
Chun alcaileacht iomlán an uisce a thomhas, is féidir leat dul i muinín stiallacha anailíseacha simplí (4 nó 7 paraiméadair a thomhas) a ligfidh duit a luach a fháil amach go tapa agus go héasca. Ar an gcaoi chéanna, is féidir leat an tomhas a dhéanamh freisin le raon leathan méadar digiteacha nó fiú fótaiméadair.
Ceannaigh táirgí chun alcaileacht na linne a thomhas
De ghnáth déantar alcaileacht a thomhas le méadar pH, a aimsíonn athruithe ar pH sa leacht atá á thástáil.
Tástáil alcaileacht le haghaidh linnte snámha
Stiallacha UISCE HOMTIKY 6 IN1 50PCS
Is stiall tanaí é cuma an táirge seo, le foirceann amháin de na bloic braite socraithe de réir an achair eolaíoch, agus an taobh eile don suíomh láimhe. Is féidir le stiall tástála amháin den táirge seo sé ghné thábhachtacha a bhrath ag an am céanna sa sampla. Laistigh de 30 soicind, is féidir cruas iomlán, clóirín iarmharach saor in aisce, clóirín iomlán, aigéad cianúrach, alcaile iomlán agus pH an uisce samplach a bhrath.
Conas an tástáil alcaileachta linn snámha a úsáid
Tástáil alcaileachta linn snámha éasca le húsáid
 |  |  |
|---|---|---|
| Snámha Snámha Tástála pH StripsTá sé deartha chun clóirín iomlán, clóirín saor in aisce, pH, alcaileacht iomlán, aigéad cianúrach agus cruas iomlán a thomhas. | Oscail an BottleEach Tá 10 bpíosa uathúla i bpacáistiú alúmanam seachtrach, atá cosanta ó thaise. | Tóg amach an stiall tástálaTóg amach an stiall tástála agus dún caipín an bhuidéil go docht tar éis é a úsáid. |
 |  |  |
|---|---|---|
| Tum san uisce é Tum an chuid daite den stiall tástála in uisce agus tarraing amach tar éis 2 shoicind é. | Fan 30 soicind Leag amach an stiall tástála agus fan 30 soicind. | Amharc ar Thorthaí Déan comparáid idir an stiall tástála agus an cárta datha ar an mbuidéal agus críochnaigh an léamh laistigh de 30 soicind chun torthaí beachta a fháil |
Cur síos ar na heilimintí braite
Cruas iomlán
Tagraíonn cruas iomlán don mhéid cailciam agus maignéisiam san uisce. Ba cheart go mbeadh cruas iomlán an uisce linn snámha agus spá idir 250 agus 500 mg/L.
Clóirín iarmharach saor in aisce, clóirín iomlán
Is é clóirín an dífhabhtán is coitianta in uisce linn snámha agus spá, agus is é a phríomhchuspóir ná ábhar salaithe san uisce a dhíghalrú agus a ocsaídiú, rud a thugann cosaint do shnámhóirí. Tugtar clóirín iarmharach saor in aisce ar chlóirín a bhfuil linnte gníomhacha aici agus atá in ann ábhair shalaithe san uisce a ocsaídiú. Tugtar clóirín comhcheangailte ar chlóirín a bhfuil a chumhacht díghalraithe ídithe aige trí imoibriú le hábhar salaithe. Is ionann clóirín iomlán agus suim an chlóirín saor iarmharaigh agus clóirín faoi cheangal. Ba cheart go mbeadh an t-iarmhar clóirín iarmharach saor in aisce sa linn idir 0,3 agus 1 mg / L, agus ba cheart go mbeadh an clóirín iarmharach saor in aisce molta san uisce teirmeach idir 3 agus 5 mg / L.
aigéad cianúrach
Déanann aigéad cianúrach, ar a dtugtar "cobhsaitheoir" nó "oiriúntóir," clóirín níos cobhsaí nuair a bhíonn sé faoi lé ghathanna ultraivialait na gréine. Tá roinnt aigéad cianúrach cheana féin i dhá chomhdhúil chlóirín (dé-ocsa agus tríocsa). Is féidir le húsáid leanúnach aon cheann de na díghalráin seo leibhéal an aigéid chianúraigh a mhéadú. Caithfidh an cion d'aigéad cianúrach a bheith níos lú ná nó cothrom le 50 mg/L.
NÓTAÍ:
Chun torthaí tástála aigéad cianúrach a fháil, caithfidh an pH a bheith idir 7.0-8.4 agus ní mór don alcaileacht iomlán a bheith níos lú ná nó cothrom le 240 mg/L.
alcaile iomlán
Is tomhas í an alcaileacht iomlán ar an méid substaintí alcaileach (décharbónáití agus carbónáití go príomha) atá san uisce. Má úsáidtear clóiríd sóidiam, tríchlóiríd sóidiam, nó ointment mar shláintitheoir, ba cheart go mbeadh an alcaileacht iomlán sa raon 100 go 120 mg/L. Má úsáidtear cailciam, sóidiam, nó hipoocsaíd litiam mar dhífhabhtán, ba cheart go mbeadh an leibhéal alcaileachta iomlán idir 80 agus 100 mg/L.
PH
Tagraíonn pH do neart substaintí aigéadacha nó alcaileach san uisce. Tá pH 7,0 neodrach agus ba cheart go mbeadh raon pH an uisce linn snámha agus spá idir 7,0 agus 7,8.

Nótaí:
1. Ná cuir méara fliuch isteach sa bhuidéal.
2. Ná déan teagmháil le nó éilligh bloc tástála na stiall tástála le do lámha.
3. Déan an caipín a dhéanamh níos doichte tar éis gach tarraingt siar stiall tástála.
4. Déan comparáid idir dath na stiall tástála i bhfianaise mhaith chun léamh a fháil.
5. Stóráil i gcoinníollacha fionnuar, tirim agus dorcha.
6. Moltar a ithe laistigh de 90 lá tar éis oscailt.
Réamhchúraimí maidir le húsáid imoibrithe ceimiceacha:
1. Ná cuir imoibrithe ceimiceacha nuair a bhíonn an linn snámha in úsáid.
2. Nuair a bhíonn aigéad á chur leis, ba chóir aigéad a chur le huisce, ach níor chóir uisce a chur leis an aigéad.
3. Ní mór gach imoibrí ceimiceach a úsáid go cúramach agus lean na treoracha úsáide go docht.
Ceannaigh tástáil alcaileacht linn snámha
Praghas stiallacha tástála alcaileacht uisce linne
Ceannaigh alt chun alcaileacht na linne a thomhas


